БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
Переход от анаэробного существования к аэробному - важнейший этап эволюции, ибо он открыл богатейшие источники энергии. В присутствии кислорода из глюкозы можно получить в 18 раз больше энергии, чем в его отсутствие. В ходе эволюции у позвоночных выработались два основных механизма, обеспечивающих снабжение клеток постоянным и достаточным количеством кислорода. Первый-это система кровообращения, которая активно поставляет клеткам кислород. Если бы не было системы кровообращения, то размеры аэробных организмов не превышали бы миллиметра, поскольку диффузия кислорода на большие расстояния оказалась бы слишком медленной и отставала бы от потребностей клеток. Второе важнейшее приспособление для снабжения клеток кислородом - это появление в процессе эволюции специальных молекул-переносчиков кислорода, позволившее преодолеть ограничения, накладываемые низкой растворимостью кислорода в воде. У позвоночных переносчиками кислорода служат белки гемоглобин и миоглобин. Гемоглобин, содержащийся в эритроцитах, выполняет функцию переносчика кислорода кровью. Наличие гемоглобина резко увеличивает способность крови переносить кислород - с 5 до 250 мл O2 в расчете на один литр крови. Гемоглобин играет также жизненно важную роль в транспорте углекислого газа и ионов водорода. Миоглобин, находящийся в мышцах, выполняет функцию резервного источника кислорода и облегчает транспорт кислорода в мышцах.
3.1. Кислород присоединяется к простетической группе гема
Способность миоглобина и гемоглобина связывать кислород обусловлена наличием в них неполипептидного компонента, а именно гема. Гем определяет также красный цвет этих белков. Вообще очень многие белки содержат прочносвязанные специфические неполипептидные компоненты, необходимые для проявления биологической активности. Такие компоненты получили название простетических групп. Белок, лишенный своей простетической группы, называют апопротеином.
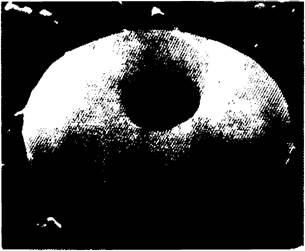
Рис. 3.1. Изображение эритроцита, полученное с помощью сканирующего электронного микроскопа
Гем состоит из органической части и атома железа. Органическая часть -протопорфирин -образована из четырех пиррольных групп. Четыре пиррола соединяются метиленовыми мостиками, образуя тетрапиррольное кольцо. К нему присоединены 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Возможны 15 вариантов пространственного расположения этих заместителей. В биологических системах присутствует только один из изомеров, называемый протопорфирин IX.
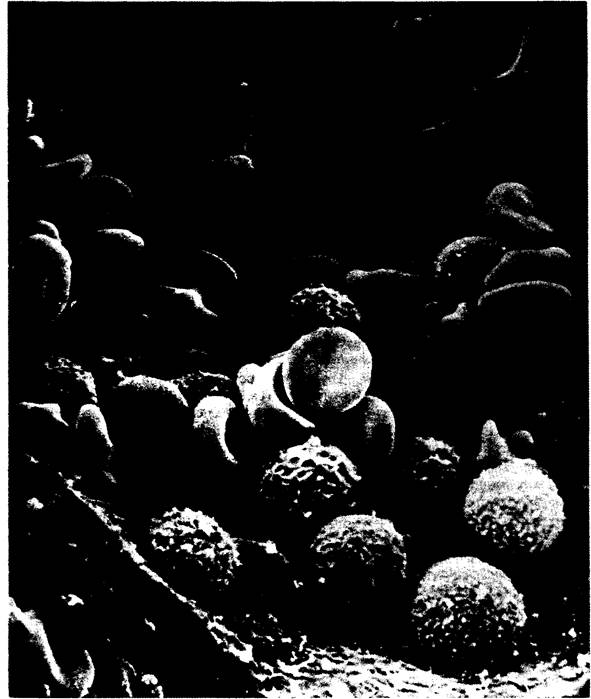
Изображение эритроцитов (двояковогнутой формы) и лейкоцитов (округлые) в мелком кровеносном сосуде, полученное с помощью сканирующего электронного микроскопа
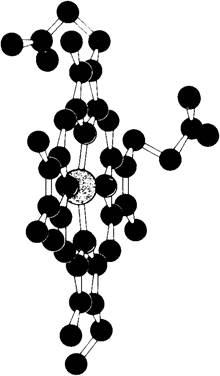
Атом железа в геме присоединен к 4 атомам азота в центре протопорфиринового кольца (рис. 3.2 и 3.3). Железо может давать еще дополнительные связи-по обе стороны плоскости гема. Эти направления связей обозначают как пятое или шестое координационные положения. Атом железа в геме может быть в ферроформе (+2) или ферриформе (+3). Соответствующие формы гемоглобина называют феррогемоглобин или ферригемоглобин. Ферригемоглобин называется также метгемоглобином. Только феррогемоглобин (+2) способен связывать кислород. Аналогичная номенклатура применима и к миоглобину.
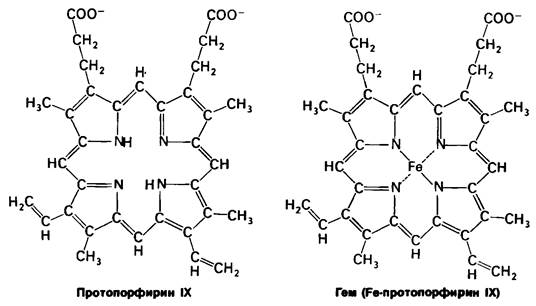
Рис. 3.2. Атом железа в геме способен образовывать шесть связей. Четыре из них расположены в плоскости гема. Пятая находится по одну сторону от этой плоскости, шестая-по другую. Расположение связанных с железом атомов называют также координационными положениями
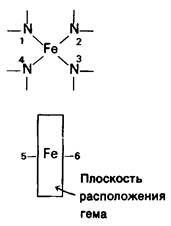
Рис. 3.3. Гем гемоглобина (желтым показано Fе, синим - N, красным-О, черным-С)