БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.5. Участок связывания кислорода в миоглобине
Группа гема локализуется в углублении на молекуле миоглобина. Высокополярные пропионатные боковые цепи гема расположены на поверхности молекулы. При физиологическом значении pH они находятся в ионизированном состоянии. Остальные части гема погружены внутрь молекулы миоглобина, где ее окружают неполярные, за исключением двух гистидинов, аминокислотные остатки. Атом железа в геме присоединен непосредственно к одному из этих гистидинов, а именно к остатку F8 (рис. 3.14 и 3.15). Этот остаток, занимающий пятое координационное положение, называется проксимальным гистидином. Атом железа примерно на 0,3 А выступает над плоскостью порфирина на стороне гистидина-F8. Участок связывания кислорода расположен по другую сторону плоскости в шестом координационном положении. Рядом располагается второй остаток гистидина (Е7), называемый дистальным. Остаток дистального гистидина-Е7 с гемом не связан. На рис. 3.16 показан участок карты электронных плотностей, включающий область гема.
Рис. 3.14. Схематическое изображение участка связывания кислорода в миоглобине. Пятое координационное положение занято гистидином F8 (проксимальный гистидин); кислород связывается в шестом координационном положении; гистидин Е7 (дистальный гистидин) расположен вблизи шестого координационного положения
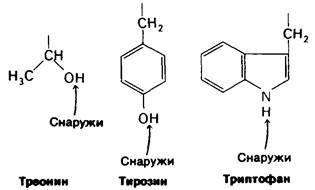
Рис. 3.15. Модель участка связывания кислорода в миоглобине. Показаны гем, проксимальный гистидин (F8) и дистальный гистидин (Е7)
Рис. 3.16. Фрагмент карты электронной плотности миоглобина вблизи участка связывания кислорода. Электронноплотная область, тянущаяся вдоль нижней части карты-спираль Е

Были исследованы три физиологически значимые формы миоглобина: дезоксимиоглобин, оксимиоглобин и ферримиоглобин. По конформации они очень сходны во всем, кроме шестого координационного положения (табл. 3.1). В ферримиоглобине в этом положении стоит вода; в дезоксимиоглобине оно свободно; в оксимиоглобине это положение занято кислородом. Связь с O2 находится под углом к связи железо-кислород (рис. 3.17). Атом железа при оксигенировании пододвигается к плоскости гема примерно на 0,2 А. Важно отметить, что гем, таким образом, не является жесткой структурой. Более того, перемещение атома железа при оксигенировании играет ключевую роль в функционировании гемоглобина, что будет показано в следующей главе (разд. 4.11).
Рис. 3.17. Наклон и ориентация связи кислорода с атомом железа в оксимиоглобине. Угол между осью O2 и связью Fe — О составляет 121°
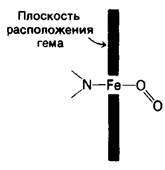
Таблица 3.1. Окружение гема

В контакт с гемом входят аминокислотные остатки, принадлежащие разным участкам линейной последовательности, в частности остатки С4 и Н14, соответствующие аминокислотам 39 и 138 линейной последовательности. Отсюда видно, что участок, связывающий гем, в своей значительной части имеет трехмерную структуру.