БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.6. Жесткое окружение гема обеспечивает обратимость оксигенирования
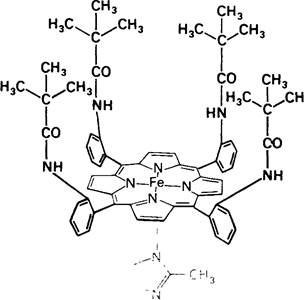
На долю участка, в котором происходит связывание кислорода, приходится лишь небольшая часть объема всей молекулы миоглобина. В самом деле, кислород непосредственно присоединяется только к атому железа в геме. Какова же роль полипептидной части молекулы в связывании и переносе кислорода? Для ответа на этот вопрос рассмотрим, как связывается кислород свободным гемом. В водном растворе свободный феррогем способен связать кислород, но лишь на короткий момент. Объясняется это тем, что в воде феррогем быстро окисляется до ферригема, который не связывает кислорода. Промежуточным продуктом в этой реакции является сандвичевое соединение, образованное двумя гемами с О2 между ними. В миоглобине гем менее чувствителен к окислению, поскольку две молекулы миоглобина практически не способны к ассоциации и образованию еандвичевого соединения гем-О2-гем. Образование такого комплекса стерически заблокировано дистальным гистидином и другими остатками, окружающими шестое координационное положение. Самые убедительные данные в пользу того, что стерические факторы определяют скорость окисления гема, были получены при изучении специально синтезированных модельных соединений. Джеймс Коллман (J. Coliman) синтезировал железопорфириновые. комплексы, огороженные «частоколом» заместителей (рис. 3.19), имитирующие участки связывания кислорода в миоглобине и гемоглобине. В этих соединениях на одной стороне порфиринового кольца имелась «огороженная» область для связывания О2, тогда как другая сторона оставалась незакрытой и могла связывать основание. Оказалось, что, если в качестве основания присоединялся замещенный имидазол, этот комплекс (рис. 3.20) приобретал такое же сродство к кислороду, как и миоглобин. Более того, «огороженность» стабилизирует ферроформу этого железопорфирина, в результате чего он приобретает способность к обратимому связыванию кислорода на длительное время. Основное различие между этим модельным соединением и обычным гемом состоит в наличие заместителей, создающих «огороженную» структуру, и тем самым блокирующих образование димерного сандвича гем -О2 - гем.
Рис. 3.18. При связывании кислорода изменяются спектры поглощения миоглобина и гемоглобина в области видимого света. Миоглобин и гемоглобин имеют очень сходные спектры поглощения видимого света
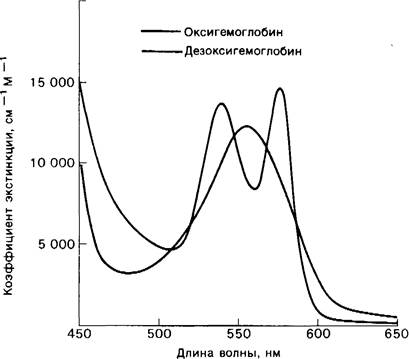
Рис. 3.19. Схематическое изображение «огороженного» железопорфирина со связанным О2. «Частокол» химических заместителей препятствует сближению двух порфиринов и образованию промежуточного продукта окисления
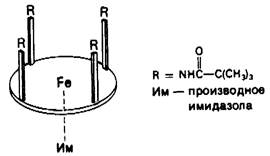
Рис. 3.20. Структурная формула «огороженного» железопорфирина
Следовательно, в миоглобине создается такое микроокружение простетической группы, благодаря которому она приобретает характерные свойства. Это общее правило, что функция простетической группы частично зависит от ее полипептидного окружения. В самом деле, тот же самый гем выполняет совершенно другую функцию в составе цитохрома с-белка конечного участка дыхательной цепи в митохондриях всех аэробных организмов. В цитохроме с гем обратимо переносит электроны, а не кислород. Наконец, совсем другую роль играет гем, входящий в состав фермента каталазы, где он разлагает перекись водорода на воду и кислород.
3.7. Присутствие дистального гистидина снижает связывание оксида углерода
Оксид углерода ядовит, так как, присоединяясь к ферромиоглобину или феррогемоглобину, он препятствует транспорту кислорода в организме. Гему свойственно высокое сродство к СО. В водном растворе связывание СО свободным гемом происходит примерно в 25 000 раз сильнее, чем связывание О2. Однако в составе гемоглобина или миоглобина сродство гема к СО превышает сродство к О2 только примерно в 200 раз. Каким же образом эти белки подавляют природное предпочтение гемом оксида углерода? Ответ был получен при рентгеноструктурном анализе и инфракрасной спектроскопии комплексов СО и О2 с миоглобином и модельными железопорфиринами, Железопорфирины обладают очень высокой степенью сродства к СО; в их комплексах с СО атомы Fе, С и О расположены на одной прямой. В комплексе же миоглобина с СО ось СО находится под углом к связи Fе—С. Расположению СО на одной прямой со связью Fе—С препятствует главным образом наличие дистального гистидина. С другой стороны, ось O2 находится под углом к связи Fе—О как в оксимиоглобине, так и в модельных соединениях. Следовательно, под влиянием белка СО координируется с железом под углом к связи Fе—С, а не на одной прямой с ней. Такая наклонная геометрия, обусловленная глобином, ослабляет взаимодействие гема с СО и в то же время создает оптимальные условия для связывания O2.
Пониженное сродство миоглобина и гемоглобина к СО имеет очень важное значение для биологических процессов. Оксид углерода представлял потенциальную опасность еще задолго до развития индустриализации. Дело в том, что СО образуется эндогенно при расщеплении гема (разд. 21.16). Таким образом, генерирование оксида углерода в организме неразрывно связано с использованием им гема. Эндогенно образуется такое количество СО, которое блокирует ~ 1% участков связывания кислорода в миоглобине и гемоглобине. Разумеется, такой уровень торможения невелик. Однако если бы относительное сродство этих белков к СО было примерно таким, какое характеризует свободные железопорфирины, то эндогенно образованный оксид углерода вызывал бы серьезное отравление. Природа решила вопрос таким образом, что в ходе эволюции появились гемосодержащие белки, которые в силу стерических факторов ослабляют связывание гемом СО, но не O2.