БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.8. В растворенном виде и в кристаллическом состоянии миоглобин имеет практически одинаковую структуру
С помощью рентгеноструктурного анализа высокого разрешения была получена замечательно детальная, хотя статическая, картина молекулы миоглобина. Возникает существенный вопрос: имеет ли растворенный миоглобин такую же структуру, как миоглобин кристаллический? Кристаллический миоглобин отличается от растворенного в том отношении, что в процессе кристаллизации он подвергается воздействию высокой ионной силы [ЗМ(NН4)2SO4] и между его отдельными молекулами возникают взаимодействия. Могут ли эти факторы так изменить структуру миоглобина, что картина, полученная при рентгеноструктурном анализе, не приближает нас к пониманию его биологической функции? Ответ на этот вопрос - решительное нет. Имеется целый ряд доказательств, что структура миоглобина в растворенном виде и в виде кристалла очень сходна.
1. В кристаллическом состоянии миоглобин функционально активен: он способен присоединять кислород, хотя реакция протекает и не так быстро, как в растворе. В целом реакционнoспособность миоглобина в кристаллическом состоянии понижена.
2. Спектр поглощения, характерный для группы гема в миоглобине, растворенном или кристаллическом, один и тот же. Спектры поглощения служат очень чувствительным показателем особенностей микроокружения гема.
3. Содержание а-спиралей в растворенной молекуле оценивают по дисперсии оптического вращения и по круговому дихроизму. Измеренное таким образом количество α-спиралей хорошо согласуется с числом а-спиралей, полученным при анализе карты электронных плотностей кристалла. Маловероятно, чтобы значительные изменения конформации не сопровождались бы изменением числа спиралей в структуре белка.
4. Рентгеноструктурный анализ миоглобина тюленя показал, что третичная структура этого белка очень близка таковой миоглобина кита. В противоположность этому кристаллические решетки этих миоглобинов весьма различны, а, следовательно, и взаимодействия между молекулами в этих двух кристаллах неодинаковы. Таким образом, маловероятно, чтобы значительные искажения структуры были бы обусловлены кристаллической решеткой.
3.9. Неполярные взаимодействия играют важную роль в стабилизировании конформации миоглобина
Рентгеноструктурный анализ выявляет структуру миоглобина, но не объясняет, почему молекула имеет данную структуру, а не иную. В сущности, одна из задач белковой химии и состоит в том, чтобы определить, каким образом аминокислотная последовательность задает трехмерную структуру белка. Изучение миоглобина показало, что внутренняя часть молекулы состоит из плотно упакованных неполярных остатков. Остатки таких аминокислот, как валин, лейцин, изолейцин, метионин и фенилаланин являются гидрофобными. При возможности выбора между водой и неполярной средой они явно предпочитают последнюю. Далее, при плотной упаковке их боковые цепи оказываются сближенными и между ними возникают вандерваальсовы силы притяжения. Таким образом, значительная сила притяжения, обеспечивающая скручивание белковой молекулы, связана с гидрофобностью указанных аминокислотных остатков, т. е. с их тенденцией к отталкиванию воды. Эти гидрофобные боковые цепи оказываются термодинамически более стабильными, если они сгруппированы внутри молекулы, а не развернуты в водной среде. Повышение стабильности при скручивании молекулы белка обусловлено ростом энтропии, происходящим при упорядоченном распределении молекул воды вокруг доступных гидрофобных групп (разд. 6.26). Итак, полипептидная цепь в водном растворе спонтанно скручивается так, что ее гидрофобные боковые цепи оказываются спрятанными внутри, а полярные, заряженные цепи-на поверхности молекулы.
3.10. Развернутая молекула миоглобина спонтанно принимает функционально активную конфигурацию
Оказывает ли гем влияние на пространственную структуру миоглобина? Ответ был получен при изучении апомиоглобина, т.е. миоглобина, лишенного гема. Апомиоглобин получают из миоглобина путем понижения pH раствора до 3,5. Поскольку при таком закислении связь между гемом и белком становится слабой, для отделения гема от белка используют экстрагирование органическим растворителем. Далее водную фазу, содержащую апомиоглобин, нейтрализуют. Измерения дисперсии оптического вращения показали, что при нейтральном значении pH степень α-спирализации в апомиоглобине составляет 60%, что значительно меньше, чем в миоглобине (75%). По данным гидродинамических исследований апомиоглобин менее компактен, чем миоглобин. Более того, стабильность апомиоглобина гораздо ниже стабильности миоглобина. Следовательно, наличие гема оказывает заметный эффект на структуру миоглобина.
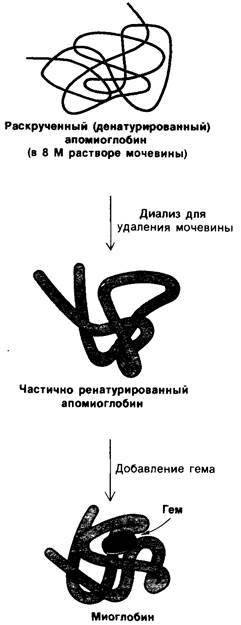
Является ли скручивание апомиоглобина и последующее включение гема спонтанным процессом? Если к нейтральному раствору апомиоглобина добавить мочевину или гуанидин, то молекула белка разворачивается (денатурирует). Содержание а- спиралей в этих условиях (т.е. в 8 М растворе мочевины) близко к нулю. После удаления мочевины путем диализа степень α-спирализации возрастает до 60%, т. е. апомиоглобин вновь скручивается. Последующее добавление гема к этому раствору приводит к образованию биологически активного миоглобина (рис. 3.22). При восстановлении в ферромиоглобин такой ренатурированный белок способен обратимо связывать кислород с исходной эффективностью. Следовательно, сложная трехмерная структура миоглобина заложена в самой природе аминокислотной последовательности апомиог ловима, соединенного с простетической группой гема. Этот вывод подтвердил универсальность принципа, впервые открытого при исследовании ренатурации рибонуклеазы, а именно: последовательность аминокислот определяет конформацию белка.
Рис. 3.22. Образование миоглобина из денатурированного апомиоглобина