БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 4. ГЕМОГЛОБИН: АЛЛОСТЕРИЧЕСКИЙ БЕЛОК
4.2. Кооперативность связывания кислорода гемоглобином
Отношение занятых кислородом участков связывания к их общему числу представляет собой степень насыщения, или просто насыщение гемоглобина кислородом, и обозначается У. Значение У изменяется от 0 (все участки свободны) до 1 (все участки заняты). График зависимости У от парциального давления кислорода рO2 называется кривой диссоциации кислорода. Кривые диссоциации кислорода для гемоглобина и миоглобина различаются в двух отношениях (рис. 4.2 и 4.3). Во-первых, при любом рO2 для миоглобина насыщение У выше, чем для гемоглобина. Другими словами, миоглобин обладает более высоким сродством к O2, чем гемоглобин. Сродство к кислороду характеризуют величиной Р50, численно равной парциальному давлению кислорода, при котором насыщены 50% участков связывания (т.е. У= 0,5). Для миоглобина Р50 составляет обычно 1 торр, а для гемоглобина-26 торр.
Рис. 4.2. Диссоциационная кривая кислорода для миоглобина и гемоглобина. Насыщенность участков, связывающих кислород, показана как функция парциального давления кислорода в окружающем растворе
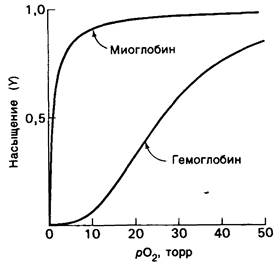
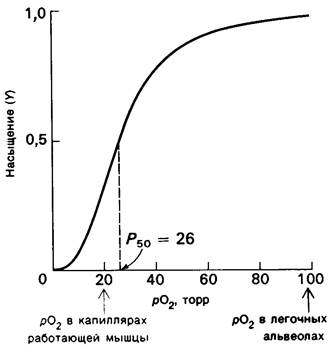
Рис. 4.3. Кривая диссоциации кислорода для гемоглобина. На оси абсцисс отмечены значения pO2, характерные для капилляров работающей мышцы и для альвеол легких. Обратите внимание, что Р50 для гемоглобина в физиологических условиях лежит между этими величинами
Торр-единица давления, численно равная тому давлению, которое производит столбик ртути высотой 1 мм при 0°С и стандартном ускорении силы тяжести (1 мм Hg). Названа в честь Эванджелисты Торричелли (1608-1647), изобретателя ртутного барометра.
Второе различие состоит в том, что кривая диссоциации кислорода в случае миоглобина имеет гиперболическую форму, а в случае гемоглобина-сигмоидную. Как будет указано ниже, сигмоидная форма кривой идеально соответствует физиологической роли гемоглобина как переносчика кислорода в крови. На молекулярном уровне сигмоидность формы означает, что связывание кислорода гемоглобином происходит кооперативно, т. е. присоединение кислорода к одному гему облегчает его присоединение к остальным.
Рассмотрим кривые диссоциации кислорода с количественной стороны, начав с миоглобина как более простого. Связывание кислорода с миоглобином (МЬ) описы-
вается следующим уравнением:
МbO2 ⇄Мb + O2. (1)
Константа равновесия процесса диссоциации оксимиоглобина составит
![]()
где [МbO2]- концентрация оксимиоглобина, [Мb]-концентрация дезоксимиоглобина, [O2]- концентрация свободного кислорода, причем все эти величины выражены в молях на литр. Степень насыщения У определяется как
![]()
Производя замещения в уравнении (3) на основе равенства (2), получаем
![]()
Поскольку O2 - это газ, удобнее выражать его концентрацию в виде рO2, т.е. парциального давления кислорода (в торрах) в окружающей раствор атмосфере. Тогда уравнение (4) принимает следующий вид:
![]()
Уравнение (5) графически выражается гиперболой. В самом деле, кривая диссоциации кислорода, рассчитанная по уравнению (5) при Р50, равном 1 торр, хорошо соответствует экспериментальной кривой, полученной для миоглобина.
В отличие от этого для гемоглобина кривая диссоциации кислорода имеет сигмоидную форму и не совпадает ни с одной кривой, описываемой уравнением (5). Это свидетельствует о кооперативном связывании О2 молекулой гемоглобина. Рассмотрим крайний случай, когда имеются только дезоксигемоглобин и гемоглобин (Нb), содержащий 4 связанные молекулы O2:
Нb(O2)4 ⇄ Нb + 4O2. (6)
Константа равновесия этой гипотетической реакции составит
![]() (7)
(7)
и далее
![]() (8)
(8)
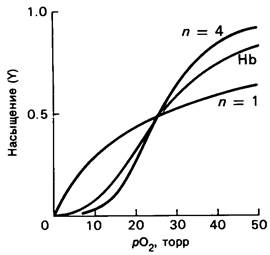
Графически уравнение (8) выражается сигмоидной кривой (рис. 4.4). Заметим, однако, что расчетная кривая идет круче, чем кривая, полученная экспериментально. Другими словами, схема процесса, описанная уравнением (6), является крайностью.
Рис. 4.4. Кривая насыщения гемоглобина кислородом лежит между диссоциационными кривыми, рассчитанными для n — 1 (некооперативное связывание) и n = 4 (полностью кооперативное связывание)
Как же тогда охарактеризовать процесс связывания с промежуточной степенью кооперативности? В 1913 г. Арчибальд Хилл показал, что кривая, построенная по данным определения связывания кислорода гемоглобином, описывается уравнением, соответствующим гипотетическому процессу:
Нb(O2) n ⇄ Нb + nO2. (9)
Насыщение У в этом случае составит
![]() (10)
(10)
После преобразований получим
![]() (11)
(11)
Последнее уравнение показывает, что отношение оксигема (У) к дезоксигему (1 — У) равно возведенному в n-ю степень отношению рO2 к Р50. Прологарифмируем это уравнение:
![]() (12)
(12)
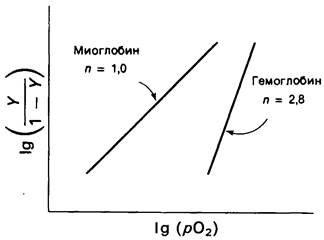
Подчеркнем, что зависимость Ig [У/(1— — У)] от Ig pO2 выразится прямой с углом наклона n. Такой график называется графиком Хилла, а величина наклона n в точке полунасыщения кислородом (У=0,5) составляет коэффициент Хилла.
Миоглобин дает линейный график Хилла с n = 1, 0, тогда как гемоглобин-с n = 2,8 (рис. 4.5). Наклон, равный 1,0, означает, что молекулы кислорода присоединяются к миоглобину независимо друг от друга, как это описано в уравнении (1). С другой стороны, коэффициент Хилла, равный 2,8, указывает на кооперативное связывание кислорода гемоглобином. Присоединение O2 к одному гему облегчает присоединение кислорода к другим гемам того же тетрамера, и обратно: отщепление кислорода от одного гема облегчает его отщепление от остальных. Другими словами, в молекуле гемоглобина имеется взаимосвязь между гемами. Кооперативность связывания кислорода гемоглобином называют иногда взаимодействием гем—гем. Механизм его мы обсудим ниже.
Рис. 4.5. График Хилла для связывания кислорода миоглобином и гемоглобином. Наклон 2,8 для гемоглобина свидетельствует о кооперативном связывании кислорода; миоглобин, напротив, связывает кислород некооперативно, о чем свидетельствует наклон кривой, равный 1,0