БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 4. ГЕМОГЛОБИН: АЛЛОСТЕРИЧЕСКИЙ БЕЛОК
4.6. Клиническое значение биофосфоглицерата
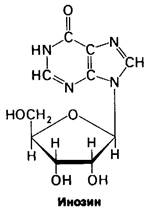
Выявление роли БФГ в транспорте кислорода сыграло важную роль в нескольких областях клинической медицины. Так, например, на протяжении ряда лет оставалось непонятным, почему в крови, консервированной в среде кислота-цитрат-декстроза (общепринятая для консервирования крови среда), сродство к кислороду возрастает: Р50 становится равным 16 вместо 26 торр. Теперь установлено, что повышение сродства к кислороду обусловлено одновременным снижением содержания БФГ с 4,5 до менее чем 0,5 мМ за 10 дней хранения крови. Сродство консервированной крови к кислороду имеет крайне важное значение в клинических условиях. Если больному переливают большое количество крови с высоким сродством к кислороду, то возникает опасность недостаточного снабжения кислородом тканей. Попавшие в кровяное русло эритроциты, полностью лишенные БФГ, восстанавливают половину его нормального содержания за 24 ч. Этот срок может оказаться неприемлемым для тяжелых больных. Таким образом, в определенных условиях следует обращать внимание на то, чтобы при переливании крови больной получил эритроциты с нормальным сродством к кислороду. Добавлением БФГ нельзя повысить его содержание в эритроцитах, так как БФГ, обладая высоким зарядом, не проходит через клеточную мембрану. Можно, однако, предотвратить снижение концентрации БФГ в консервированных клетках, добавляя в среду инозин. Незаряженные молекулы инозина проходят через мембрану эритроцита и внутри клетки в результате сложной серии реакций (разд. 15.4) превращаются в БФГ. В настоящее время инозин широко используется для сохранения функциональной полноценности консервированной крови.
Открытие роли БФГ позволило также понять и некоторые адаптивные механизмы, включающиеся при нарушении снабжения тканей кислородом (т.е. при гипоксии). Возьмем для примера больных с тяжелой обструктивной эмфиземой легких. При этом заболевании затруднено поступление воздуха в бронхиолы; в результате артериальная кровь недостаточно насыщается кислородом. рO2 в артериальной крови таких больных составляет только 50 торр, т. е. оно вдвое ниже, чем в норме. Но при этом происходит компенсаторный сдвиг кривой насыщения кислородом, обусловленный повышением концентрации БФГ с 4,5 до 8,0 мМ. При таком содержании БФГ Р50 становится равным уже не 26, а 31 торр. При Р50 = = 31 торр насыщение кислородом в артериях (УА!!!) составляет 0,82, а в венах (Уу) - 0,49; артериовенозная разница (∆У) равна 0,33. При нормальном значении Р50 (Р50 = = 26 торр) УА = 0,86, Уу = 0,60 и ∆У = 0,26. Сдвиг кривой диссоциации кислорода создает то преимущество, что увеличивает ∆У с 0,26 до 0,33. Таким образом, повышение концентрации БФГ приводит к увеличению доставки кислорода в ткани на 27%.
При некоторых нарушениях обмена веществ в эритроцитах содержание БФГ изменяется, что сопровождается соответственным изменением сродства гемоглобина к кислороду. Эти нарушения обсуждаются в одной из следующих глав (разд. 12.18).
Нерешенной проблемой физиологии дыхания является механизм адаптации к высоте. И в этом случае изменение уровня в содержании БФГ имеет, по-видимому, существенное значение. Когда человек поднимается от уровня моря на высоту 4500 м, уже через 2 дня концентрация БФГ в его эритроцитах возрастает с 4,5 до 7,0 мМ и соответственно снижается сродство к кислороду. Насыщение артериальной крови кислородом уменьшается из-за снижения Р50, но количество транспортируемого кислорода возрастает (возрастает ∆У), так как больше высвобождается кислорода в капиллярной сети. При спуске с гор на уровень моря концентрации БФГ и Р50 возвращаются к исходным величинам.
4.7. Гемоглобин плода характеризуется высоким сродством к кислороду
Эмбрионам свойственен особый тип гемоглобина - гемоглобин F (α2γ2), который, как уже упоминалось ранее, отличается от гемоглобина взрослых. Важнейшая особенность гемоглобина F состоит в том, что в физиологических условиях его сродство к кислороду выше, чем сродство к кислороду у гемоглобина А (рис. 4.9). Более высокое сродство к кислороду гемоглобина F создает оптимальные условия для транспорта кислорода из крови матери в кровь плода. Гемоглобин F оксигенируется за счет гемоглобина А (находящегося по другую сторону трансплацентарного барьера в кровеносной системе плаценты).
Рис. 4.9. Эритроциты плода обладают более высоким сродством к кислороду, чем эритроциты матери. В присутствии бисфосфоглицерата сродство к кислороду гемоглобина плода выше, чем у гемоглобина матери
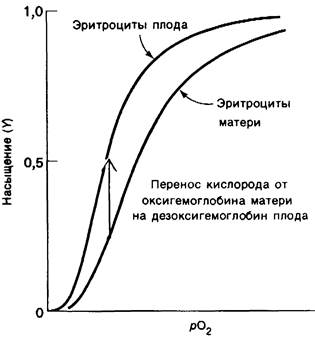
Высокое сродство крови плода к кислороду известно уже на протяжении многих лет, однако причина этого явления выяснилась лишь недавно. Оказалось, что гемоглобин F слабее связывает БФГ, чем гемоглобин А, и, следовательно, обладает более высоким сродством к O2. В самом деле, в отсутствие БФГ величины сродства этих гемоглобинов располагаются в обратном порядке. Это казалось загадочным до тех пор, пока не выяснилось, что экспериментальное определение кривых диссоциации кислорода следует проводить при добавлении БФГ, поскольку это соединение присутствует в эритроцитах как плода, так и взрослого.
4.8. Для проявления аллостерического эффекта необходимо взаимодействие субъединиц
Рассмотрим структурную основу аллостерических эффектов. Гемоглобин можно расщепить на составляющие его полипептидные субъединицы. Выделенные а-цепи гемоглобина по своим свойствам имеют много общего с миоглобином. Сама по себе α-цепь характеризуется высоким сродством к кислороду, гиперболической кривой диссоциации кислорода и таким связыванием O2, которое нечувствительно к изменению pH, концентрации СO2 и содержанию БФГ. Изолированные р-цепи легко образуют тетрамер β4, называемый гемоглобином Н. Подобно α-цепи и миоглобину, β4 полностью лишен аллостерических свойств. Отсюда следует, что аллостерические свойства гемоглобина возникают в результате взаимодействия субъединиц. Функциональная единица гемоглобина-это тетрамер, состоящий из полипептидных цепей двух типов.
4.9. Четвертичная структура гемоглобина значительно изменяется при оксигенировании
В 1937 г. Феликс Гауровиц (F. Haurowitz) обнаружил, что кристаллы дезоксигемоглобина при оксигенировании разрушаются. Объясняется это тем, что структура оксигемоглобина заметно отличается от структуры дезоксигемоглобина и оксигенированные молекулы уже не укладываются в кристаллическую решетку дезоксигемоглобина. В противоположность этому на кристаллы миоглобина, так же, как и на кристаллы β4, оксигенирование не влияет.
Как показал рентгеноструктурный анализ, окси- и дезоксигемоглобин существенно различаются по четвертичной структуре (рис. 4.10). Оксигенированная молекула более компактна. Например, при присоединении O2 расстояние между атомами железа в р-цепях уменьшается с 39,9 до 33,4 А. Особый интерес представляют изменения в области контактов между α- и β-цепями. Существуют два типа контактов между α и β-цепями, обозначаемые соответственно α1β1- и α1β2-контактами (рис. 4.11). При переходе гемоглобина из окси- в дезоксиформу α1β1-контакт практически не меняется, тогда как а1β2-контакт претерпевает большие структурные изменения. В результате присоединения кислорода одна пара субъединиц ар поворачивается относительно другой пары αβ на 15° (рис. 4.12). Некоторые атомы в этой области раздела перемещаются на расстояние, достигающее 6 А. По существу, область контакта α1 функционирует как переключатель с одной структуры на другую. Каждая из форм такого похожего на ласточкин хвост контакта стабилизирована собственным набором водородных связей (рис. 4.13).
Рис. 4.10. Проекция части карт электронных плотностей оксигемоглобина (красный) и дезоксигемоглобина (синий), полученная при разрешении 5,5 А. Показаны спирали А и Н двух Р!!!-цепей гемоглобина. Центральная часть схемы соответствует центральному углублению в молекуле. Здесь показано одно из конформационных изменений гемоглобина, сопутствующих присоединению кислорода, а именно сближение двух Н-спиралей
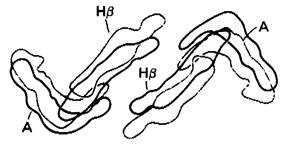
Рис. 4.11. Модель оксигемоглобина при низком разрешении. Показаны два вида контактов между α и β-цепями. α-Цепи изображены белым, β-цепи-серым. Три гема, видные на модели, обозначены буквой Н. Область α2β1-контактов показана синим, а a^-контакта- желтым
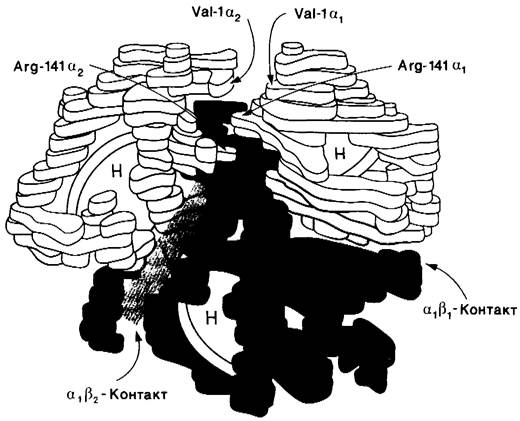
Рис. 4.12. Схема, иллюстрирующая изменения четвертичной структуры гемоглобина при оксигенировании. Одна пара αβ- субъединиц сдвигается по отношению к другой путем поворота на 15° и продвижения на 0,8 А. Оксиформа повернутой пары оф!!!-субъединиц показана красным, дезоксиформа-синим
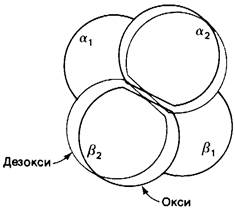
Рис. 4.13. Область о^р2-контакта при оксигенировании переходит от Т-формы к R-форме. Конфигурация контактирующих поверхностей в виде ласточкина хвоста позволяет двум субъединицам легко скользить относительно друг друга
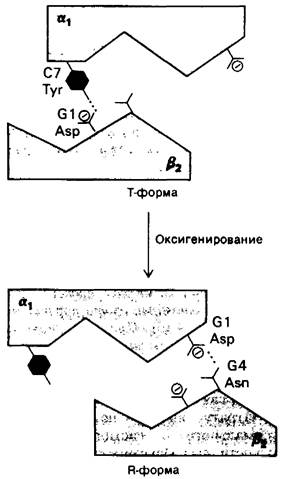
Контакт α1β2 расположен вблизи гемов. Следовательно, структурные изменения в этой области могут оказывать влияние на гем. Важное значение контакта подтверждается также и тем, что у всех позвоночных он состоит в основном из одних и тех же аминокислотных остатков. Кроме того, практически при всех мутациях, затрагивающих контакт α1β2, взаимодействие гем—гем оказывается сниженным, тогда как при мутациях контакта α1β1 этого не происходит.