БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 4. ГЕМОГЛОБИН: АЛЛОСТЕРИЧЕСКИЙ БЕЛОК
4.10. Солевые связи между отдельными цепями придают жесткость структуре дезоксигемоглобина
В оксигемоглобине С-концевые остатки во всех четырех цепях обладают практически полной свободой вращения. В дезоксигемоглобине, напротив, эти концевые группы заякорены (рис. 4.14), Дело в том, что, во- первых, карбоксильный конец α-цепи взаимодействует с аминоконцом α2-цепи, Во- вторых, боковая цепь аргинина на этом С-конце образует связь с аспартатом а2-цепи. В-третьих, карбоксильный конец ргцепи связан с боковой цепью лизина, принадлежащего а2-цепи. Наконец, имидазольная боковая цепь С-концевого остатка β1-цепи взаимодействует с боковой цепью аспартата, также принадлежащего β1-цепи. Эти пары аминокислотных остатков образуют так называемые солевые связи, т. е. нековалентные электростатические связи между противоположно заряженными группами. Из-за образования этих восьми солевых связей дезоксигемоглобин имеет более жесткую, напряженную структуру, чем оксигемоглобин.
Рис. 4.14. Перекрестные связи между субъединицами в дезоксигемо- глобине. При оксигенировании эти нековалентные электростатические связи легко разрываются
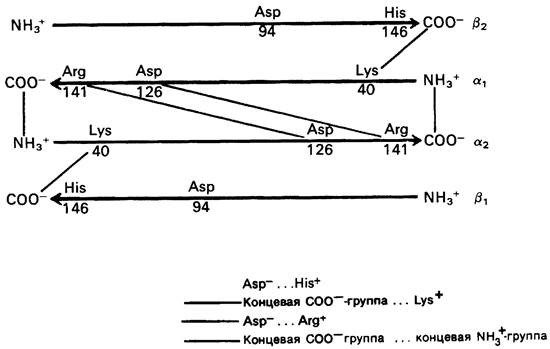
Четвертичная структура дезоксигемоглобина обозначается как Т-форма (от англ, tense-напряженная), тогда как четвертичная структура оксигемоглобина-как R-форма (от англ. relaxed-релаксированная). Обозначения Т и R обычно используются для описания альтернативных четвертичных структур аллостерических белков, причем Т- форма всегда имеет меньшее сродство к субстрату.
4.11. При оксигенировании атом железа перемещается в плоскость порфирина
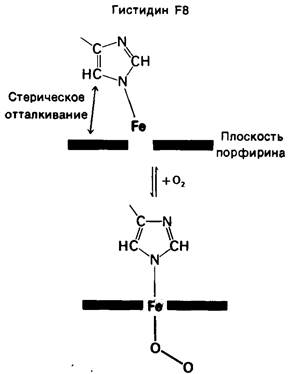
Выше речь шла о конформационных изменениях, происходящих на некотором расстоянии от гема. Посмотрим теперь, что происходит с самим гемом при оксигенировании. В дезоксигемоглобине атом железа выступает примерно на 0,6 А из плоскости гема вследствие стерического отталкивания, возникающего между проксимальным гистидином и атомами азота порфиринового кольца (рис. 4.15). При оксигенировании атом железа перемещается в плоскость порфирина, образуя прочную связь с O2. Прирост энергии, обусловленный формированием этой связи, более чем в 10 раз покрывает затрату энергии на передвижение проксимального гистидина ближе к плоскости гема. Изучение структуры большого числа синтезированных железопорфиринов показало, что в соединениях, где занято 5 координационных положений, атом железа лежит вне плоскости гема, но если заняты все 6 координационных положений, то атом железа находится в плоскости или почти в плоскости гема. Локализация атома железа зависит также от спина его электронов, а именно высокоспиновое состояние способствует расположению вне плоскости.
Рис. 4.15. При оксигенировании атом железа перемещается в плоскость гема. Проксимальный гистидин (F8) тянется вслед за атомом железа и становится менее наклоненным. Атом железа исходно не лежит в плоскости гема вследствие стерического отталкивания, возникающего между атомом углерода имидазольного кольца и атомом азота гема
4.12. Движение атома железа передается на другие субъединицы через проксимальный гистидин
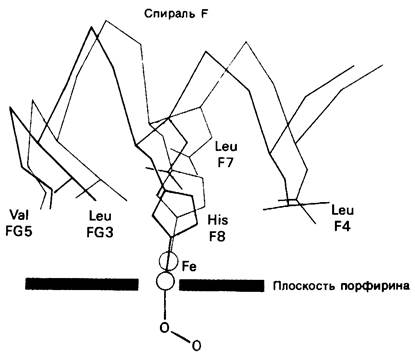
Каким образом перемещение атома железа в плоскость гема может способствовать переключению четвертичной структуры с Т- формы на R? Ключевым элементом в передаче структурных изменений от гема одной субъединицы к другой субъединице служит боковая цепь проксимального гистидина, которую тянет за собой перемещающийся атом железа (рис. 4.16). Гем и проксимальный гистидин образуют тесные контакты с боковыми цепями 15 аминокислотных остатков, и потому при оксигенировании меняются структуры спирали F, углов ЕF и FG. Эти сдвиги передаются затем на области межсубъединичных контактов. Тирозин НС2, располагавшийся в кармане между спиралями F и Н, выдвигается наружу, что приводит к разрыву солевых связей между цепями. В результате равновесие между двумя четвертичными структурами при оксигенировании сдвигается в сторону R- формы. Итак, изменение структуры внутри одной субъединицы (оксигенирование) приводит к изменению структуры в области контактов субъединиц. Таким путем присоединение кислорода к одному гему передается на отдаленные от этого гема части молекулы.
Рис. 4.16. К он формационные изменения, индуцированные движением атома железа при оксигенировании. Проксимальный гистидин притягивается атомом железа и становится менее наклоненным. Оксигенированная структура показана красным, дезоксигенированная - синим
4.13. Механизм кооперативного связывания кислорода
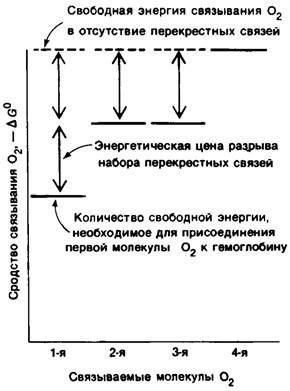
Почему четвертая молекула O2 связывается гемоглобином примерно в 300 раз прочнее, чем первая? Понять это явление можно из аналогии, приведенной на рис. 4.17. Дезоксигемоглобин имеет жесткую структуру, усиленную восемью солевыми связями между четырьмя субъединицами. Присоединение кислорода может произойти лишь после того, как разрыв каких-то из этих связей позволит атому железа переместиться в плоскость гема. Сколько должно разорваться солевых связей, чтобы присоединилась молекула O2? Это зависит от того, какая по счету молекула должна присоединиться: первая, вторая, третья или четвертая. Для связывания первой молекулы O2 необходимо разорвать больше связей, чем для связывания последующих. Поскольку разрыв солевых связей требует энергии, присоединение первой молекулы O2 энергетически менее выгодно, чем присоединение остальных. Присоединение же второй и третьей молекул 02 по величине затраты энергии занимает промежуточное положение между первой и четвертой (рис. 4.18). Такое постепенное увеличение сродства к кислороду придает кривой связывания O2 ту сигмоидность формы, которая выявляется экспериментально.
Рис. 4.17. Пояснение хода оксигенирования гемоглобина на примере почтовых марок. Для того чтобы оторвать одну марку из четырех, нужно разорвать две перфорированные стороны. Чтобы отделить вторую марку, нужно произвести разрыв только с одной стороны; чтобы отделить третью-тоже с одной. После этого четвертая марка остается свободной

Рис. 4.18. Свободная энергия связи последовательных молекул O2 (ср. с моделью, описанной на рис. 4.17). Сродство связывания (-∆G°) возрастает, так как для присоединения четвертой молекулы O2 нужно разорвать меньше перекрестных связей, чем для присоединения первой
Этот аллостерический механизм можно описать и на уровне более тонкой структуры. Почти все молекулы дезоксигемоглобина находятся в Т-форме. По мере последовательного связывания молекул O2 возрастает вероятность перехода в К-форму. Сродство Т-формы к O2 в 300 раз ниже, чем сродство R-формы, так как в Т-форме передвижение проксимального гистидина в плоскость гема имеет больше ограничений. В частности, в Т-форме проксимальный гистидин больше наклонен к плоскости гема (см. рис. 4.16), а потому и увеличено стерическое отталкивание, препятствующее его перемещению. Более симметричное положение проксимального гистидина в R-форме облегчает его приближение к гему. Кроме того, в Т-форме участок связывания O2 в β- субъединице заслонен валином Е11 в большей степени, чем в R-форме.