БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 5. МОЛЕКУЛЯРНЫЕ БОЛЕЗНИ: СЕРПОВИДНОКЛЕТОЧНАЯ АНЕМИЯ
ВОПРОСЫ И ЗАДАЧИ
1. При проведении программы обследования обнаружен гемоглобин с аномальной электрофоретической подвижностью. Судя по пептидной карте трипсинового гидролизата гемоглобина, замена аминокислоты произошла в β-цепи. Отсутствует нормальный N-концевой триптический пептид (Val-Нis-Lеu-Тhr-Рго-Glu- Glu-Lys). Обнаружен новый триптический пептид, состоящий из 6 аминокислотных остатков. N-концевым остатком в этом пептиде оказался валин.
а) Замене каких аминокислот соответствуют эти данные?
б) Как этот гемоглобин должен отличаться от НbА и НbS по электрофоретической подвижности при pH 8?
2. Ниже показана электрофоретическая подвижность ряда мутантных гемоглобинов А при pH 8,6.
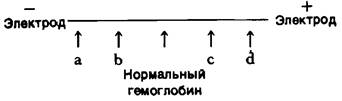
Как распределяются места а, b, с и d между гемоглобинами следующего состава:

3. Некоторые мутации гена гемоглобина оказывают влияние на все три гемоглобина А1, А2 и F, тогда как другие-только на один из них. Почему?
4. Если гемоглобин человека с признаком серповидноклеточности (т.е. гетерозиготного по гену серповидноклеточности) подвергнуть электрофорезу на крахмальном геле, то выявляются две основные полосы. Одна из них-НbА (α2β2), вторая- НbS (α2β2). Отсутствие третьей полосы с промежуточной электрофоретической подвижностью дало основание думать, что гибридной молекулы α2βS не существует. Однако в дальнейшем такой гибридный гемоглобин был обнаружен в растворе. Почему он не выявляется при электрофорезе на крахмальном геле? (Подсказка: подумайте о влиянии электрического поля на равновесие 2(α2ββS) ⇄ α2β2 + α2β2S.)
5. НbА тормозит образование длинных волокон из НbS и последующую деформацию эритроцитов (в серповидные клетки) при дезоксигенировании. Как объяснить этот эффект НbА?
6. При высокой ионной силе гемоглобин расщепляется в участке α1β2-контакта на αβ-димеры. Какова способность к диссоциации окси- и дезоксиформы гемоглобина Кеmpseу по сравнению с гемоглобином А?