БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
Химические реакции в биологических системах редко протекают в отсутствие катализатора. Роль таких катализаторов выполняют специфические белки, называемые ферментами. Всем ферментам свойственны удивительно высокая каталитическая сила и специфичность. При этом активность многих ферментов регулируется. Кроме того, ряд ферментов непосредственно участвует в трансформации различных форм энергии. Рассмотрим эти отличительные свойства ферментов, имеющие крайне важное значение для биологических процессов.
6.1. Ферменты обладают огромной каталитической силой
Ферменты ускоряют реакции по крайней мере в миллион раз. В самом деле, в отсутствие ферментов скорость большинства реакций в биологических системах практически неощутима. Даже такая простая реакция, как гидратирование диоксида углерода.
В отсутствие фермента перенос СO2 из тканей в кровь и затем в воздух легочных альвеол был бы неполон. Карбоангидраза, катализирующая эту реакцию, принадлежит к числу самых активных ферментов из всех известных. Каждая молекула карбоангидразы способна гидратировать 105 молекул СO2 в 1 с. Скорость реакции гидратирования СO2 в присутствии фермента в 107 раз выше, чем в его отсутствие.
6.2. Ферменты обладают высокой специфичностью
Ферменты обладают высокой специфичностью как в отношении катализируемой ими реакции, так и в отношении субстратов, т. е. участвующих в реакции веществ. Каждый фермент катализирует какую-либо одну химическую реакцию или же несколько очень сходных реакций. Степень специфичности к субстрату обычно высока, а иногда практически абсолютна.
Рассмотрим в качестве примера протеолитические ферменты. Они катализируют реакцию гидролиза пептидной связи:
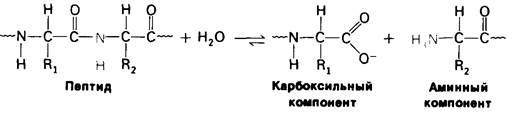
катализируется ферментом:
CO2 + H2O ⇄ H2CO3.
Многие протеолитические ферменты катализируют иную, но сходную реакцию, а именно гидролиз эфирной связи:
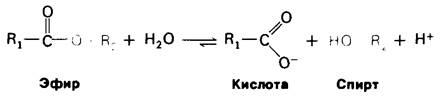
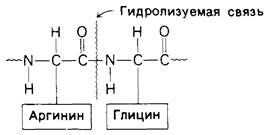
Протеолитические ферменты сильно различаются по степени субстра тной специфичности. Так. субтилизин, синтезируемый определенным видом бактерий, расщепляет пептидную связь независимо от природы, прилежащей к ней боковой цепи. С другой стороны, трипсин, как уже упоминалось в гл. 2. проявляет высокую специфичность в том отношении, что расщепляет пептидные связи, образованные карбоксильными группами только лизина и аргинина (рис. 6.1). Тромбин, участвующий в свертывании крови, проявляет еще более высокую специфичность, чем трипсин. Он разрывает только те пептидные связи, которые образованы карбоксильной группой аргинина и аминогруппой глицина (рис. 6.2).
Рис. 6.1. Сггецифичность трипсина
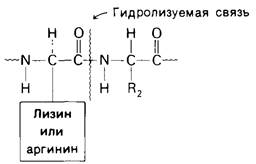
Рис. 6.2. Специфичность тромбина (фактора свертывания крови)
Другим примером высокой степени специфичности ферментов может служить ДНК-полимераза I. Этот фермент синтезирует ДНК. соединяя друг с другом четыре типа нуклеотидов-строительных блоков ДНК. Последовательность нуклеотидов в синтезируемой цепи ДНК определяется последовательностью нуклеотидов в другой цепи ДНК, играющей роль матрицы (рис. 6.3). ДНК-полимераза 1 отличается поразительно высокой точностью в выполнении тех инструкций, которые задаются матрицей. В синтезируемых цепях ДНК ошибочно включенный нуклеотид встречается реже чем один раз на миллион.
Рис. 6.3. Электронная микрофотография молекул ДНК-полимеразы I (белые сферические частицы), присоединившейся к нитевидной синтетической ДНК-матрице