БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 7. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ: ЛИЗОЦИМ И КАРБОКСИПЕПТИДАЗА
7.8. Карбоксипептндаза А: протеолитический фермент, содержащий цинк
Перейдем теперь к карбоксипептидазе А- пищеварительному ферменту, гидролизующему С-концевую пептидную связь в полипептидах. Особенно легко гидролизуются пептиды, в которых С-концевой остаток имеет ароматическую или большую алифатическую боковую цепь. Этот фермент интересен в том отношении, что по механизму катализа он принципиально отличается от лизоцима. Прежде чем перейти к подробному обсуждению механизма действия карбоксипeптидазы А, отметим два основных аспекта.
1. Индуцированное соответствие. Связывание субстрата сопровождается значительными изменениями структуры фермента.
2. Смещение электронов. В активном центре фермента содержатся атом цинка и другие группы, которые индуцируют перераспределение электронов в субстрате, облегчая тем самым процесс гидролиза.
Трехмерную структуру карбоксипептидазы А (рис. 7.23) при разрешении в 2 А получил в 1967 г. Уилльям Липском (W. Lipscomb). Фермент содержит одну полипептидную цепь из 307 аминокислот, имеет компактную форму, которую можно приближенно описать как эллипсоильную с размерами 50 х 42 х 38 А. 38 А. И ферменте -имеются области α-спиралей (38%) и β-складчатых слоев (17%). С белком прочно связан ион цинка, наличие которого необходимо для проявления ферментативной активности. Ион цинка расположен в углублении близко к поверхности молекулы, причем он образует координационные связи (в виде тетраэдра) с боковыми цепями двух гистидинов, боковой цепью глутамата и молекулой воды (рис. 7.24). Рядом с ионом цинка на ферменте имеется большого размера «карман», в который попадает боковая цепь концевого остатка пептидного субстрата.
Рис. 7.23. Трехмерная структура карбоксипептидазы А. Показаны только а-углеродные атомы и ион цинка (заштрихованный кружок в центре)
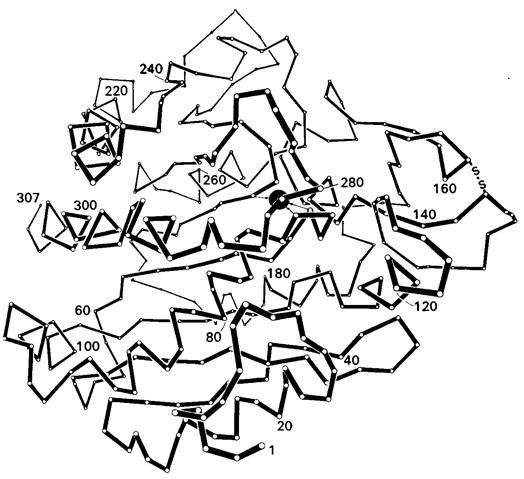
Рис. 7.24. Ион цинка, расположенный в активном центре карбоксипептидазы А, образует координационные связи с боковыми цепями двух гистидинов и глутамата. Занимающая 4-ю координационную связь молекула воды здесь не показана
7.9. Связывание субстрата индуцирует большие структурные изменения активного центра карбоксипептидазы А
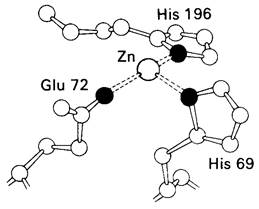
Представление о характере связывания субстратов с карбоксипептидазой А возникло на основе данных, полученных при изучении структуры комплекса этого фермента с глицилтирозином. Глицилтирозин - медленно гидролизуемый субстрат. Процесс его связывания (рис. 7.25 и 7.26) можно представить в виде пяти последовательных этапов.
Рис. 7.25. Схематическое изображение связывания глицилтирозина в активном центре карбоксипептидазы А. Показан постулированный каталитически активный комплекс
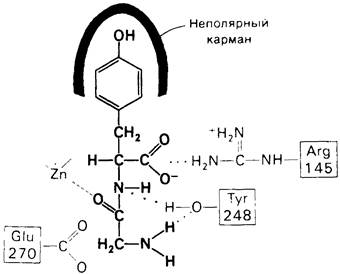
Рис. 7.26. Пространственное расположение глицилтирозина в активном центре карбоксипептидазы А. Глицилтирозин (субстрат) изображен красным
1. Отрицательно заряженная концевая карбоксильная группа глицилтирозина вступает в электростатическое взаимодействие с положительно заряженной боковой цепью аргинина-145.
2. Субстрат через боковую цепь своего тирозина связывается в неполярном кармане фермента.
3. Водород NН-группы той пептидной
связи, которая должна гидролизоваться, соединяется водородной связью с ОН-группой ароматической боковой цепи тирозина-248.
4. Карбонильный кислород той же пептидной связи вступает в координационную связь с ионом цинка.
5. Концевая аминогруппа субстрата образует водородную связь через вклинивающуюся молекулу воды с боковой цепью глутамата-270. Это взаимодействие, вероятно, не имеет места в случае реакционноспособного ЕS-комплекса, и именно оно, возможно, является причиной крайне медленного гидролиза глицилтирозина.
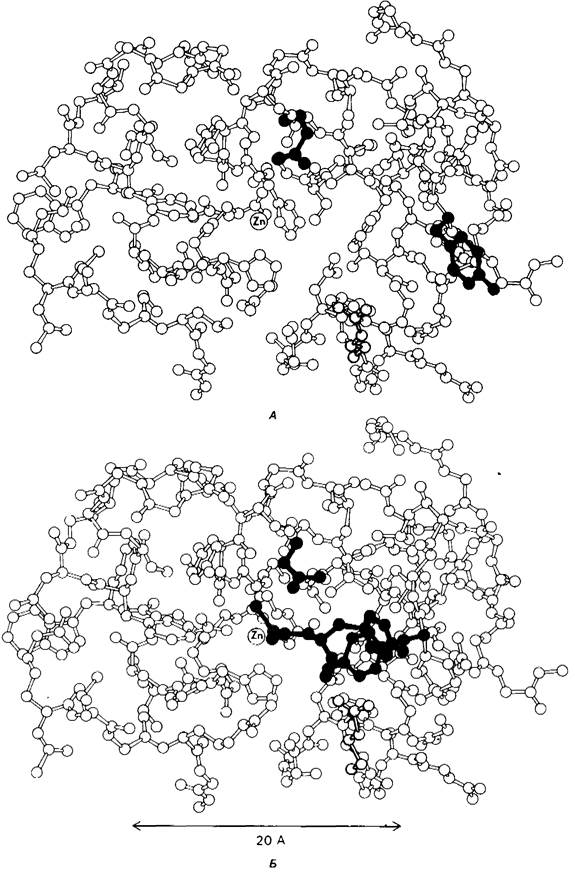
Связывание глицилтирозина сопровождается структурной перестройкой активного центра (рис. 7.27). В сущности, только присоединив субстрат, каталитические группы фермента принимают правильную ориентацию положение, впервые постулированное Кошландом (Коshland) в его модели индуцированного соответствия. Гуанидиниевая группа аргинина-145, а также карбоксильная группа глутамата-270 перемещаются на 2 А. Связывание карбонильной группы субстрата с ионом цинка вытесняет из связи с цинком молекулу воды. По крайней мере еще четыре молекулы воды вытесняются из неполярного кармана на ферменте при связывании с ними тирозиновой боковой цепи в молекуле субстрата. Самое большое изменение конформации - это перемещение фенольного гидроксила тирозина-248 на 12 А, т. е. на расстояние, составляющее около 1 /4 диаметра молекулы. Такое перемещение осуществляется в первую очередь, путем свободного вращения относительно одинарной связи —С—С— и состоит в том, что гидроксильная группа тирозина-248, бывшая на поверхности молекулы, перемещается, оказываясь вблизи пептидной связи субстрата. В результате закрывается полость активного центра и тем самым завершается превращение ее из области, заполненной водой, в гидрофобную. Все эти структурные изменения инициируются, по- видимому, связыванием аргинина-145 с концевой карбоксильной группой субстрата.
Рис. 7.27. Структура карбоксипептидазы А меняется при связывании субстрата ; А - фермент без субстрата (Arg 145 показан желтым, Glu 270-зеленым, Туг 248-синим); Б-фермент- субстратный комплекс (глицилтирозин, субстрат, изображен красным). На рисунке показана только часть молекулы фермента
7.10. Скорость катализа карбоксипептидазой А возрастает благодаря смещению электронов
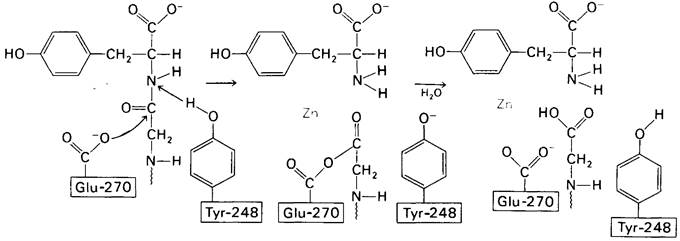
На основе данных рентгеноструктурного анализа Липском (Lipscomb) предложил механизм каталитического действия карбоксипептидазы А. Постулированная структура реакционноспособного ES-комплекса показана на рис. 7.28. Согласно предложенному механизму, ОН-группа тирозина-248 отдает протон на NH-группу расщепляемой пептидной связи. Карбонильный атом углерода этой пептидной связи подвергается атаке со стороны карбоксильной группы глутамата-270, которая выступает в данном случае как нуклеофильная группа. Образующийся в результате ангидрид глутамата-270 и кислотного компонента субстрата подвергается далее гидролизу.
Рис. 7.28. Постулированный механизм каталитического действия карбоксипептидазы А: Glu-270 непосредственно атакует карбонильный углеродный атом гидролизуемой пептидной связи, а Туг-248 отдает протон на NH-группу этого пептида. Образующийся в результате ангидрид далее подвергается гидролизу
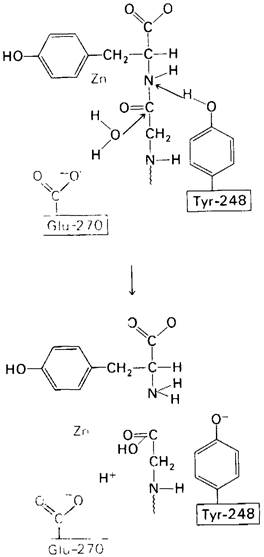
Возможен и другой механизм катализа, также согласующийся с данными рентгеноструктурного анализа; он показан на рис. 7.29. По этой схеме глутамат-270 активирует молекулу воды. Образующийся ОН- непосредственно атакует карбонильный атом углерода расщепляемой пептидной связи. Одновременно тирозин-248 отдает протон на ее NH-группу, и в итоге пептидная связь гидролизуется. Этот механизм катализа отличается от механизма, приведенного на рис. 7.28, тем, что предполагает гидролиз водой непосредственно пептидной связи субстрата, а не промежуточно образующегося ангидрида. Проведенные в последнее время химические и спектроскопические исследования свидетельствуют о том, что гидролиз пептидных субстратов осуществляется по прямому механизму, тогда как гидролиз эфиров протекает через промежуточное образование ангидрида с глутаматом-270.
Рис. 7.29. Второй возможный механизм каталитического действия карбоксипептидазы А.
Туг 248 выполняет ту же функцию, что и на рис. 7.28. В остальном процесс протекает иначе: Glu 270 активирует молекулу воды, которая атакует карбонильный атом углерода расщепляемой пептидной связи. Гидролиз осуществляется прямо, без промежуточного образования ангидрида
Какова роль цинка в этих схемах катализа? Карбонильная группа расщепляемой пептидной связи обращена к иону цинка таким образом, что связь С=O оказывается более поляризованной, чем обычно; это делает карбонильный атом углерода более чувствительным к нуклеофильной атаке. Неполярное окружение иона цинка увеличивает его эффективный заряд и тем самым его способность индуцировать диполь. Сильной поляризации карбонильной группы способствует также близость отрицательного заряда глутамата-270. Следовательно, карбокиспептидаза А индуцирует такое смещение электронов на субстрате, которое повышает скорость катализа.
Теперь мы можем оценить значение индуцированных субстратом структурных изменений в активном центре карбоксипептидазы А. В результате связавшийся на ферменте субстрат оказывается со всех сторон окруженным каталитическими группами. Это обеспечивает возможность катализа по причинам, о которых говорилось выше. Совершенно очевидно, что только гибкость структуры фермента обеспечивает попадание субстрата в сферу действия системы каталитических групп (и выход продуктов реакции из этой системы). В целом гибкая структура фермента имеет преимущество перед жесткой в том отношении, что она обладает гораздо большим выбором возможных конформаций, пригодных для катализа и сохраняющихся в процессе отбора. Кроме того, индуцированное соответствие вносит вклад в повышение специфичности фермента. В самом деле, в случае карбоксипептидазы А субстрат должен иметь концевой карбоксилат-ион; фермент «проверяет» его наличие таким путем: если концевой карбоксилат-ион имеется, то он образует солевую связь с аргинином-145, а это вызывает перемещение тирозина-248 в каталитически активное положение; если же концевого карбоксилат-иона нет, то тирозин-248 остается на месте и фермент не проявляет активности. Другими словами, индукция соответствия может функционировать как динамический процесс узнавания.