БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 8. АКТИВАЦИЯ ПРОФЕРМЕНТОВ: ПИЩЕВАРИТЕЛЬНЫЕ ФЕРМЕНТЫ И ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ
Ферментативно активная форма лизоцима возникает в результате спонтанного складывания молекулы с образованием характерной для этого фермента трехмерной структуры. В отличие от лизоцима многие другие белки синтезируются в форме неактивных предшественников, которые затем активируются в результате расщепления одной или нескольких специфических пептидных связей. Если каталитически активный белок называется ферментом (или энзимом), то неактивный предшественник фермента называется проферментом (или зимогеном).
Активация белков путем специфического протеолиза-процесс, широко распространенный в биологических системах. Приведем несколько примеров.
1. Пищеварительные ферменты, гидролизующие белки, синтезируются в желудке и поджелудочной железе в виде проферментов (табл. 8.1).
Таблица 8.1. Проферменты, синтезируемые в желудке и поджелудочной железе

2. Свертывание крови опосредовано каскадом реакций протеолитической активации, обеспечивающим быстрый и нарастающий по силе ответ на травму.
3. Некоторые белковые гормоны синтезируются в виде неактивных предшественников. Например, инсулин образуется из проинсулина в результате протеолитического удаления пептида.
4. Фибриллярный белок коллаген, содержащийся в большом количестве в коже и костях, образуется из растворимого предшественника - проколлагена.
8.1. Активация химотрипсиногена происходит путем специфического расщепления одной пептидной связи
Химотрипсин - это пищеварительный фермент, гидролизующий белки в тонком кишечнике. Как и ряд других проферментов и пищеварительных ферментов, он синтезируется в поджелудочной железе в форме неактивного предшественника - химотрипсиногена. Вообще поджелудочная железа-это один из органов, наиболее активно синтезирующих белки. Ферменты и их предшественники синтезируются в ацинарных клетках поджелудочной железы (рис. 8.1). Внутри этих клеток новосинтезированные белки транспортируются из эндоплазматического ретикулума в аппарат Гольджи, где окружаются белково-липидной мембраной; так образуются зимогеновые гранулы, которые в электронном микроскопе выглядят как очень плотное тельца. Высокая электронная плотность зимогеновых гранул обусловлена содержанием большого количества белка (рис. 8.2). Зимогеновые гранулы накапливаются в верхушке ацинарных клеток и затем под действием гормонального или нервного сигнала секретируются в проток, ведущий в двенадцатиперстную кишку.
Рис. 8.1. Схематическое изображение секреции проферментов (зимогенов) ацинарной клеткой поджелудочной железы
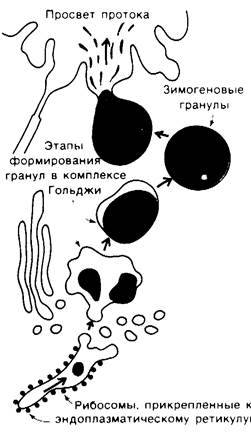
Рис. 8.2. Электронная микрофотография зимогеновых гранул в ацинарных клетках поджелудочной железы

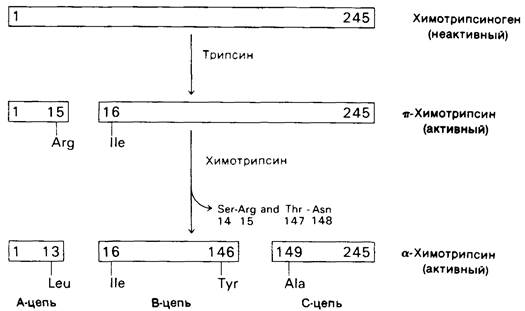
Химотрипсиноген образован одной полипептидной цепью, состоящей из 245 аминокислот. Цепь связана пятью дисульфидными мостиками. Химотрипсиноген практически полностью лишен ферментативной активности. Однако он превращается в активный фермент, когда под действием трипсина расщепляется пептидная связь между аргинином-15 и изолейцином-16 (рис. 8.3). Образующийся активный фермент, называемый П-химотрипсином, действует затем на другие молекулы п-химотрипсина. В результате удаления еще двух пептидов образуется стабильная форма фермента - α-химотрипсин. Дополнительное расщепление при превращении п-химотрипсина в α-форму в сущности излишне, поскольку л-химотрипсин сам обладает полной ферментативной активностью. Поразительная особенность данного процесса активации состоит в том, что расщепление всего лишь одной специфической пептидной связи превращает белок из каталитически неактивной формы в полностью активную.
Рис. 8.3. Активация химотрипсиногена