БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 8. АКТИВАЦИЯ ПРОФЕРМЕНТОВ: ПИЩЕВАРИТЕЛЬНЫЕ ФЕРМЕНТЫ И ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ
8.11. Трипсин и эластаза: вариации на тему
Трипсин и эластаза сходны с химотрипсином во многих отношениях.
1. Все три фермента секретируются поджелудочной железой в виде проферментов и активируются путем расщепления одной- единственной пептидной связи. Возникающая при этом концевая аминогруппа загибается внутрь молекулы и электростатически связывается с карбоксилат-ионом аспар- тата-194.
2. Последовательность расположения около 40% аминокислот в этих трех ферментах идентична. Для аминокислотных остатков, локализованных во внутренней части молекулы, степень идентичности еще выше.
3. Фторофосфаты, в частности ДИФФ, игнибируют все три фермента. Подобно химотрипсину, и трипсин, и эластаза содержат в активном центре остаток серина. Более того, во всех трех ферментах одинакова последовательность аминокислот, окружающих серин: Glу-Asр-Sег-Glу-Glу-Рго.
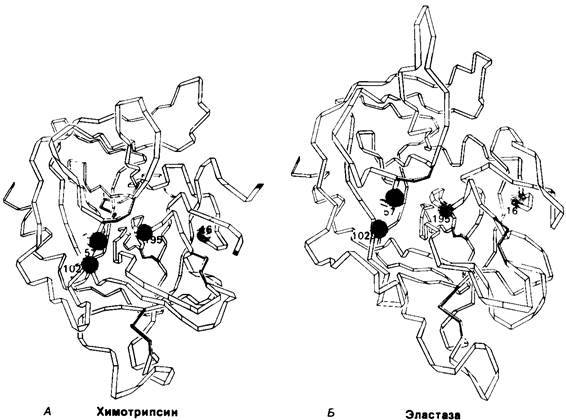
4. При рентгеноструктурном анализе было выявлено большое сходство третичной структуры этих трех ферментов (рис. 8.21). В эластазе и трипсине, как и в химотрипсине, имеется система переноса заряда, а также полость оксианиона.
Рис. 8.21. Сравнение конформации основной цепи химотрипсина (A) и эластазы (Б). Локализация системы переноса заряда (остатки 102, 57 и 195) и α-аминогруппы остатка 16 выделена цветом, чтобы подчеркнуть сходство структуры этих ферментов
5. Механизм каталитического действия всех трех ферментов почти одинаков. Их эффективность в качестве катализаторов обеспечивается тем, что они стабилизируют переходное состояние реакции. Полость оксианиона и система переноса заряда, это те существенно важные структурные элементы каждого из ферментов, которые способствуют образованию тетраэдрического промежуточного соединения.
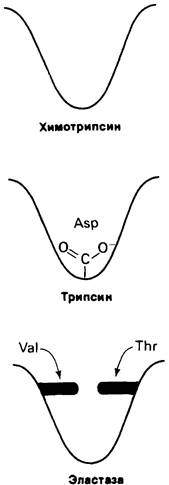
Будучи сходными по структуре и механизму действия, эти ферменты поразительным образом различаются по специфичности. Субстрат химотрипсина должен иметь ароматическую или большую неполярную боковую цепь. Для трипсина требуется субстрат, содержащий лизин или аргинин. Ни один из этих субстратов не пригоден для эластазы, проявляющей специфичность в отношении небольших незаряженных боковых цепей. Как показал рентгеноструктурный анализ, эта разница в специфичности рассматриваемых ферментов обусловлена очень небольшими структурными различиями участков связывания субстрата (рис. 8.22). В химотрипсине ароматические
и большие неполярные боковые цепи субстрата размещаются в неполярном кармане. В трипсине имеется такой же карман, отличающийся, однако, от неполярного кармана химотрипсина заменой одного остатка- вместо серина стоит аспартат. Этот аспартат в неполярном кармане трипсина образует прочную электростатическую связь с положительно заряженными боковыми цепями лизина или аргинина субстрата. В эластазе же нет такого кармана для субстрата, поскольку два остатка глицина, выстилающие карман в химотрипсине, в эластазе заменены остатками валина и треонина, имеющими значительно большие размеры.
Рис. 8.22. Очень упрощенное изображение участка связывания субстрата в химотрипсине, трипсине и эластазе
Структурные изменения, происходящие при активации трипсиногена, несколько отличаются от изменений, связанных с активацией химотрипсиногена. Рентгеноструктурные исследования, проведенные независимо Робертом Хьюбером и Робертом Строудом (R. Huber, R. Stroud), показали, что при активации трипсиногена происходят значительные изменения конформации четырех протяженных отрезков полипептида, составляющих примерно 15% молекулы. Эти области, названные доменами активации, не имеют устойчивой структуры в проферменте, но приобретают строго определенную конформацию в трипсине. Кроме того, полость оксианиона в трипсиногене расположена слишком далеко от гистидина-57 и поэтому не может способствовать образованию тетраэдрического промежуточного соединения.
8.12. Ингибитор панкреатического трипсина прочно связывается в активном центре трипсина
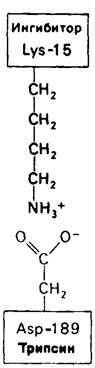
Регуляция активности панкреатических протеин аз осуществляется двумя различными путями. Первый превращение профермента в активную протеиназу путем расщепления одной пептидной связи. Это очень точный механизм «включения» ферментативной активности, однако он необратим, и, следовательно, для остановки протеолиза должен существовать второй регуляторный механизм. Эту функцию выполняют специфические ингибиторы протеиназ. Например, панкреатический ингибитор трипсина, белок массой 6 кДа, ингибирует активность трипсина, очень прочно связываясь с его активным центром (рис. 8.23). Константа диссоциации комплекса составляет 10-13 М, что соответствует стандартной свободной энергии связывания примерно — 18 кДа/моль. Примечательная особенность этого взаимодействия состоит в том, что комплекс не диссоциирует ни в 8 М растворе мочевины, ни в 6 М гаунидингидрохлориде. Между тем эти денатурирующие агенты практически всегда вызывают диссоциацию олигомеров белка на составляющие субъединицы. Такая удивительная стабильность рассматриваемого комплекса объясняется тем, что ингибитор трипсина является очень эффективным аналогом субстрата. Рентгеноструктурный анализ показал, что боковая цепь лизина-15 в молекуле ингибитора соединяется с боковой цепью аспартата в субстрат-специфичном кармане фермента. Кроме того, между полипептидными цепями фермента и ингибитора возникает большое число водородных связей. Они располагаются так же, как водородные связи между ферментом и истинным субстратом. Но что самое главное-карбонильная группа лизина-15 и окружающие ее атомы ингибитора плотно входят в полость оксианиона в ферменте. Однако весь комплекс как будто застывает на этом промежуточном этапе катализа - видимо, потому, что гистидин-57 фермента, будучи неподвижным, лишен возможности перебросить протон на амидный азот ингибитора. Пептидная связь между лизином-15 и аланином-16 в панкреатическом ингибиторе трипсина расщепляется, но с крайне малой скоростью. Период полужизни комплекса трипсин-ингибитор составляет несколько месяцев. Ингибитор обладает очень высоким средством к трипсину в силу почти идеальной комплементарности его структуры активному центру трипсина. Ограниченная подвижность конформации ингибитора в участке его связывания с ферментом блокирует процесс катализа и приводит к исключительно высокой прочности комплекса с трипсином.
Рис. 8.23. Основной элемент взаимодействия панкреатического ингибитора трипсина с трипсином состоит в образовании электростатической связи между лизином-15 ингибитора и аспартатом-189 фермента. Кроме того, —NНз+-группа лизина-15 соединяется водородной связью с несколькими атомами кислорода в субстрат-специфичном кармане молекулы трипсина