БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 8. АКТИВАЦИЯ ПРОФЕРМЕНТОВ: ПИЩЕВАРИТЕЛЬНЫЕ ФЕРМЕНТЫ И ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ
8.13. Дивергентная и конвергентная эволюция сериновых протеиназ
Химотрипсин, эластаза и трипсин обладают в целом сходной последовательностью аминокислотных остатков, поскольку они возникли из общего предшественника. Ген фермента-предшественника, по-видимому, несколько раз удваивался. В результате последующих мутаций этих генов появились в конце концов современные ферменты. Возникновение различной специфичности в ходе мутаций генов, произошедших от общего предшественника, представляет собой процесс дивергентной эволюции.
Сравнивая химотрипсин с бактериальным ферментом субтилизином, мы сталкиваемся с эволюционным процессом другого типа.
Субтилизин - это также сериновая протеиназа. Однако последовательности аминокислот в химотрипсине и субтилизине совершенно различны, что указывает на их независимое появление в процессе эволюции. Например, в молекуле химотрипсина имеется пять дисульфидных мостиков, тогда как в субтилизине-ни одного. Последовательность аминокислот вокруг серина в активном центре субтилизина и химотрипсина имеет следующий вид:
-Gly-Thr- Ser *-Met-Ala-Ser в субтилизине
-Gly-Asp- Ser *-Gly-Gly-Pro в химотрипсине
Совершенно различны трехмерные структуры этих ферментов. Тем более удивительным оказалось сообщение о том, что в субтилизине имеется система переноса заряда, состоящая, как и в химотрипсине, из остатков аспарагиновой кислоты, гистидина и серина. Более того, в субтилизине имеется полость оксианиона, стабилизирующая тетраэдрическое промежуточное соединение. Сходство системы переноса заряда, полости оксианиона и механизма катализа в случае субтилизина и химотрипсина-это поразительный пример независимой, конвергентной эволюции на уровне молекул ферментов. Почему независимые, параллельные эволюционные процессы привели к одному и тому же решению в таких разных случаях, как сериновые протеиназы поджелудочной железы позвоночных и бактериальный субтилизин? Как описывается далее (разд. 8.16), существует, по-видимому, довольно мало способов расщепления пептидных связей. Изучение нескольких сотен протеолитических ферментов показало, что имеется, быть может, только четыре основных типа механизмов протеолиза и что сериновые протеиназы распространены наиболее широко.
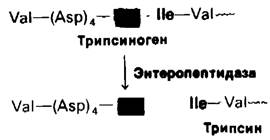
8.14. Координированная активация панкреатических проферментов
Расщепление белков в двенадцатиперстной кишке требует одновременного действия нескольких протеолитических ферментов, поскольку каждый из них специфичен в отношении ограниченного числа боковых цепей. Следовательно, все проферменты должны превращаться в активные ферменты в одно и то же время. Координированный контроль процесса активации достигается тем, что для всех панкреатических проферментов - трипсиногена, химотрипсиногена, проэластазы и прокарбоксипептидазы-имеется один общий активатор - трипсин. Откуда же берется достаточно большое количество трипсина, необходимое для активации этих проферментов? Дело в том, что клетки, выстилающие двенадцатиперстную кишку, секретируют фермент энтеропептидазу1, которая по мере поступления трипсиншена в двенадцатиперстную кишку гидролизует в нем пептидную связь лизин-изолейцин. Образующееся при этом небольшое количество трипсина активирует трипсиноген и другие проферменты. Таким образом, образование трипсина под действием энтеропептидазы этап активации активатора:
8.15. Преждевременная активация проферментов может приводить к летальному исходу, в частности при панкреатите
Существует множество путей защиты поджелудочной железы от протеолитического действия синтезируемых ею ферментов. Прежде всего все панкреатические ферменты, гидролизующие белки, синтезируются в виде неактивных проферментов. Далее, в клетках поджелудочной железы они находятся в гранулах, окруженных белковолипидной мембраной. Еще одна мера защиты присутствие в секрете поджелудочной железы ингибитора (разд. 8.12), инактивирующего те небольшие количества трипсина, которые могут в ней оказаться.
Рис. 8.24. Схематическое изображение поджелудочной железы и ее связи с тонкой кишкой
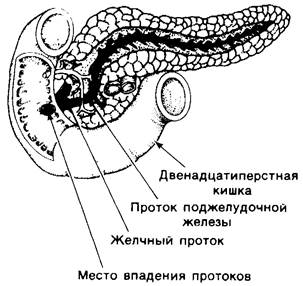
Поджелудочная железа секретирует также липазы. Одна из них, а именно фосфолипаза А2 синтезируется в виде ирофосфолипазы А2, которая затем активируется трипсином. Другие ферменты, расщепляющие жиры, проявляют активность в присутствии солей желчных кислот, поступающих в двенадцатиперстную кишку из печени. Действие этих стероидов состоит в том, что они солюбилизируют липиды, тем самым делая их доступными для ферментативного расщепления липазами. Желчь синтезируется в печени, накапливается в желчном пузыре и из него выделяется в двенадцатиперстную кишку, где вместе с панкреатическими липазами участвует в расщеплении жиров.
Существует тяжелое, иногда со смертельным исходом, заболевание -острый панкреатит. Болезнь эта характеризуется преждевременной активацией протеолитических и липолитических ферментов поджелудочной железы. При панкреатите эти ферменты проявляют активность, еще находясь в самой поджелудочной железе. В результате происходит разрушение ткани железы и стенок пронизывающих ее сосудов. Причиной острого панкреатита может быть травма ацинарной ткани.