БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 8. АКТИВАЦИЯ ПРОФЕРМЕНТОВ: ПИЩЕВАРИТЕЛЬНЫЕ ФЕРМЕНТЫ И ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ
8.16. Основные типы протеолитических ферментов-это сериновые протеиназы и карбоксипротеиназы
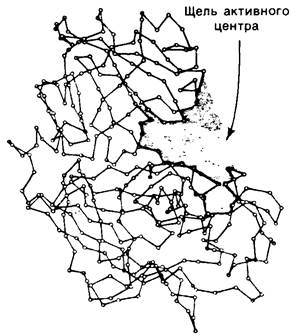
До сих пор мы рассматривали два класса протеолитических ферментов, а именно цинксодержащие протеиназы (на примере карбоксипептидазы А-см. разд. 7.8) и сериновые протеиназы. Широко распространена также группа тиоловых протеиназ. Так, в папаине, получаемом из папайи, в активном центре имеется цистеин, роль которого аналогична роли серина-195 в химотрипсине. Катализ папаином протекает через образование тиоэфира в качестве промежуточного соединения; в катализе участвует расположенная вблизи боковая цепь гистидина. Другая большая группа протеолитических ферментов включает карбоксипротеиназы, или, как их еще называют, кислые протеиназы, поскольку большинство из них активно только в кислой среде. Наиболее известный представитель этой группы -пепсин, главный протеолитический фермент желудочного сока. Пепсин мол. массой 34,6 кДа образуется из пепсиногена (профермента) путем отщепления N-концевого пептида, состоящего из 44 аминокислотных остатков. Эта активация либо происходит спонтанно (при pH 2 и ниже), либо катализируется пепсином. В итоге пепсиноген, секретированный в полость желудка, превращается в пепсин в течение нескольких секунд. В активном центре пепсина содержатся два остатка аспартата. Для проявления ферментативной активности один остаток аспартата должен находиться в ионизированной, другой-в неионизированной форме; это определяет оптимум pH для пепсина - между 2 и 3. Сходные по структуре и ферментативным свойствам карбоксипротеиназы были выделены из лизосом, осуществляющих внутриклеточное расщепление (разд. 20.8), а также из различных плесневых грибов (рис. 8.25). Все карбоксипептидазы ингибируются пепстатином (аналогом гексапептидного переходного промежуточного соединения), добавленным в очень низких концентрациях (порядка 10-10 М).
Рис. 8.25. Структура кислой протеиназы из плесени Rhizopus. Показаны α-углеродные атомы. Активный центр расположен между двумя долями молекулы во впадине, где размещаются 8 аминокислотных остатков субстрата. Пепсин имеет очень сходную структуру
8.17. Свертывание крови как каскад реакций активации проферментов
Активация белка-предшественника путем разрыва пептидной связи-это один из основных способов регуляции, свойственный различным биологическим системам. Сейчас мы рассмотрим роль активации проферментов при образовании кровяного сгустка, представляющем собой один из трех механизмов гемостаза. Два других способа регуляции-это быстрое сужение поврежденного сосуда и агрегация тромбоцитов на его стенке для защиты поврежденной поверхности сосуда.
Образование кровяного сгустка происходит в результате цепи последовательных превращений, осуществляемых при участии более чем 10 различных белков. Поразительная особенность этого процесса состоит в том, что он включает в себя серию актов активации проферментов. В этом каскаде ферментативных реакций активированная форма одного фактора свертывания крови катализирует активацию следующего. В силу каталитической природы процесса факторы, действующие на начальных этапах пути, требуются в очень малых количествах. Их эффект усиливается многократно благодаря большому числу последующих этапов, что обеспечивает в итоге быструю ответную реакцию на травму.
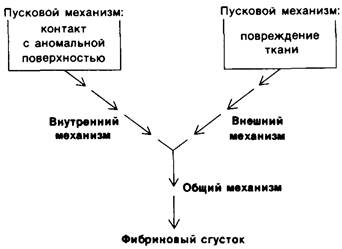
8.18. Образование кровяного сгустка требует взаимодействия двух типов ферментативных превращений
В 1863 г. Джозеф Листер (J. Lister) обнаружил, что в иссеченной яремной вене быка кровь остается жидкой, тогда как в стеклянной посуде она немедленно свертывается. Соприкосновение с неприродной поверхностью приводило к высвобождению компонентов, исходно присутствовавших в крови. Соответственно этот механизм (путь) свертывания крови был назван внутренним. Однако и вещества, в обычных условиях не присутствующие в крови, также могут вызвать свертывание. Так, при добавлении к плазме экстрактов многих тканей, в особенности мозга, происходит быстрое формирование кровяного сгустка. Этот механизм (путь) свертывания называется внешним.
При свертывании крови внешний и внутренний механизмы (пути) действуют взаимосвязанно (рис. 8.26). Для нормального свертывания крови необходимы оба механизма, о чем свидетельствуют различные нарушения способности к свертыванию крови, связанные с недостаточностью какого- либо из белков, участвующих лишь в одном из механизмов. Внешний и внутренний механизмы различаются только на начальных этапах, а затем они объединяются в общий путь, приводящий к образованию фибринового сгустка.
Рис. 8.26. В образование сгустка фибрина вовлекается взаимодействие трех путей превращений
8.19. Фибриноген превращается в фибриновый сгусток под действием тромбина
Наиболее изученный этап процесса свертывания, это превращение фибриногена в фибрин под действием протеолитического фермента-тромбина. Фибриноген отличается от рассмотренных ранее белков (например, от лизоцима и химотрипсина) значительно большей массой и удлиненностью формы. По данным электронной микроскопии, фибриноген имеет вид трех узелков, соединенных двумя тяжами (рис. 8.27). Длина молекулы -460 А, масса-340 к Да, что примерно в 10 раз больше массы химотрипсина. Фибриноген состоит из шести полипептидных цепей, которые попарно разделяются на три типа, причем первая пара обозначается Аα, вторая Вβ и третья γ.
Рис. 8.27. Схематическое изображение молекулы фибриногена по данным электронной микроскопии
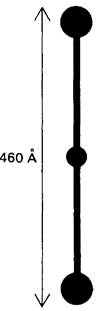
Рис. 8.28. Электронная микрофотография модифицированного фибриногена, обладающего упорядоченной структурой. Длина повторяющегося отрезка по оси волокна равна 225 А, как и в фибрине

Фибриноген, легко растворимый белок плазмы, в результате протеолитического действия тромбина превращается в нерастворимый мономер фибрина. Тромбин расщепляет в фибриногене четыре пептидные связи между аргинином и глицином. В результате этого расщепления высвобождаются четыре пептида: А-пептид из 18
остатков от каждой из двух α-цепей и В-пептид из 20 остатков от каждой из двух β-цепей. Эти А- и В-пептиды называют фибринопептидами. Молекула фибриногена, лишенная фибринопептидов, представляет собой мономер фибрина. Его субъединичная структура _ (α, β, γ)2; он содержит около 97% аминокислотных остатков фибриногена.