БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 8. АКТИВАЦИЯ ПРОФЕРМЕНТОВ: ПИЩЕВАРИТЕЛЬНЫЕ ФЕРМЕНТЫ И ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ
8.20. Мономеры фибрина спонтанно образуют фибриллы
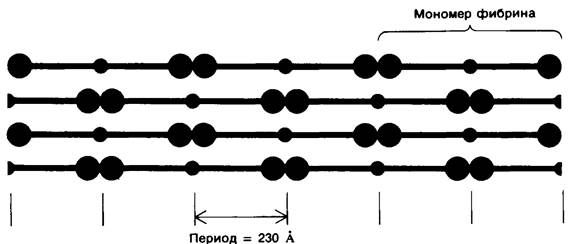
Растворимость мономеров фибрина значительно ниже растворимости фибриногена. Они спонтанно агрегируют, образуя фибрин, имеющий форму длинных нерастворимых нитей (фибрилл). Методами электронной микроскопии и дифракции рентгеновских лучей, направленных под малым углом, показано, что фибрин обладает периодической структурой с длиной повторяющегося участка 230 А (рис. 8.29). Поскольку длина фибриногена составляет около 460 А, т.е. вдвое больше, представляется вероятным, что мономеры фибрина при агрегации образуют параллельные ряды, сдвинутые относительно друг друга на пол молекулы (рис. 8.30).
Рис. 8.29. Электронная микрофотография фибрина. Длина периода структуры по оси волокна составляет 230 А, т.е. половину длины молекулы фибриногена

Рис. 8.30. Предполагаемое расположение мономеров фибрина в фибриновом сгустке. При такой укладке мономеров фибрина, когда параллельные ряды оказываются сдвинутыми относительно друг друга на полмолекулы, длина периода структуры составляет 230 А в соответствии с реально существующей картиной
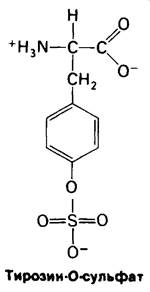
Чем объяснить, что мономеры фибрина способны агрегировать, а фибриноген, из которого они образуются, нет? Окончательный ответ на этот вопрос дадут проводящиеся детальные исследования структуры молекул. Все изученные к настоящему времени фибринопептиды всех видов позвоночных обладают большим отрицательным зарядом. В них обнаружено обилие остатков глутаминовой и аспарагиновой кислот. Кроме того, в В- фибринопептиде имеется необычное отрицательно заряженное производное тирозина, а именно тирозин-О- сульфат. Видимо, наличие этих, а также и других отрицательно заряженных групп вызывает отталкивание молекул фибриногена друг от друга. Высвобожденные тромбином мономеры фибрина обладают поверхностью с совершенно другими электрическими свойствами, обусловливающими способность к агрегации. Вспомним, что замена всего лишь одной заряженной группы - глутамата на валин - является причиной агрегации дезоксигемоглобина при серповидноклеточной анемии.
8.21. Сгусток фибрина стабилизирован ковалентными поперечными связями
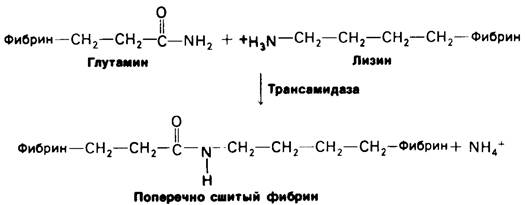
Сгусток, образующийся при спонтанной агрегации мономеров фибрина-еще очень слабый и рыхлый. Затем он стабилизируется ковалентными поперечными связями между боковыми цепями отдельных молекул в фибриновых нитях. Установлено, что в ходе реакции трансамидирования пептидные связи образуются между боковыми цепями специфических остатков глутамина и лизина (рис. 8.31). Фермент, катализирующий эту реакцию, трансамидаза. Поперечные связи указанного типа встречаются в белках крайне редко. Значение их видно из того, что у больных с врожденной недостаточностью трансамидазы повышена кровоточивость.
Рис. 8.31. Перекрестные связи в фибрине образуются в результате трансамидирования
8.22. Тромбин гомологичен трипсину
Способность тромбина специфически расщеплять связь между остатками аргинина и глицина свидетельствует, по-видимому, о сходстве тромбина с трипсином. И действительно, такое сходство имеется, что явствует из сопоставления последовательностей остатков аминокислот в этих белках. Тромбин имеет массу 33,7 кДа и состоит из двух цепей. Цепь А из 49 остатков не проявляет заметной гомологии с ферментами поджелудочной железы. Цепь В, напротив, очень сходна с трипсином, химотрипсином и эластазой по последовательности аминокислот. Последовательность аминокислот вокруг серина в активном центре тромбина: Glу-Аsр-Sег-Glу-Сlу-Рго, т.е. такая же, как и в сериновой протеиназе поджелудочной железы. Более того, в тромбине имеется и система переноса заряда. Ее трехмерная структура еще не раскрыта, но установлена одна важная особенность, характеризующая участок специфического связывания: в тромбине, как и в трипсине, на дне кармана, связывающего субстрат, находится остаток аспартата. Эта отрицательно заряженная группа несомненно должна электростатически связывать положительно заряженную боковую цепь аргинина субстрата. Специфичность тромбина значительно выше, чем специфичность трипсина: тромбин расщепляет только определенные связи аргинин-глицин, тогда как трипсин гидролизует почти любую пептидную связь, следующую за остатками аргинина или лизина.
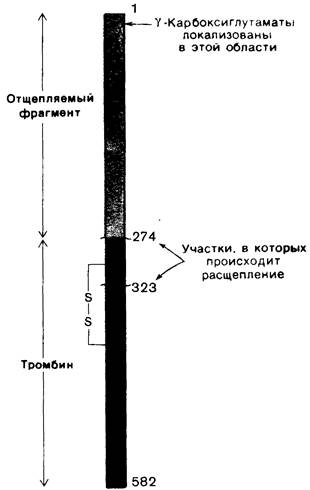
Как и панкреатические сериновые протеиназы, тромбин синтезируется в виде профермента -протромбина, имеющего мол. массу 66 кДа. В результате протеолитического расщепления связи аргинин—треонин с аминоконца протромбина высвобождается фрагмент массой 32 кДа (рис. 8.32). Последующее расщепление связи аргинин—лейцин приводит к высвобождению активного тромбина. В тромбине имеется также ионная пара, аналогичная ионной паре в химотрипсине между положительно заряженной аминогруппой изолейцина-16 и отрицательно заряженным аспартатом-194.
Рис. 8.32. Структура протромбина. В результате расщепления двух пептидных связей (Аrg-274— Тhr-275 и Аrg-323—Ilе-324) образуется тромбин. Красным показан отщепляемый N-концевой фрагмент протромбина, в котором локализованы все остатки γ-карбоксиглутамата. А- и В-цепи тромбина соединены дисульфидной связью
Сходство последовательностей аминокислотных остатков указывает на то, что тромбин эволюционно близок к сериновым протеиназам поджелудочной железы. Подтверждением этому служат также сходство механизмов активации сравниваемых ферментов и наличие в них системы переноса заряда. Примечательно, что протромбин синтезируется в печени, имеющей в процессе эмбриогенеза общее с поджелудочной железой происхождение.
8.23. Для синтеза протромбина необходим витамин К
На протяжении многих лет было известно, что витамин К необходим для синтеза протромбина и ряда других факторов свертывания крови. Однако механизм действия этого витамина удалось раскрыть совсем недавно путем исследования аномального протромбина, синтезируемого в отсутствии витамина К или же в присутствии антагониста витамина К, например, дикумарола. Дикумарол содержится в гниющем доннике, и скот, получающий испорченное сено, погибает от геморрагической болезни. Производное дикумарола используется в медицине в качестве антикоагулянта для предотвращения тромбозов у больных с повышенной свертываемостью крови. Дикумарол, а также варфарин (рис. 8.33), родственный витамину К по структуре и его антагонист, нашли применение и в качестве сильного крысиного яда. Под влиянием дикумарола в крови коров появляется дефектный протромбин, который в отличие от нормального не способен связывать Са2 +. Довольно долго это представлялось загадкой, потому что по количеству содержащихся аминокислот и по аминокислотному составу, определенному после кислотного гидролиза, дефектный протромбин не отличался от нормального. При разделении нормального протромбина на фрагменты было показано, что связывание Са2+ происходит в N-концевой области белка (рис. 8.34). Далее было обнаружено, что N-концевой пептид аномального протромбина значительно отличается от соответствующего пептида нормального протромбина по электрофоретической подвижности. Изучение этих пептидов методом ядерного магнитного резонанса позволило установить, что в норме протромбин содержит ранее неизвестную аминокислоту - γ-карбоксилглутамат; в аномальном протромбине эта модифицированная аминокислота отсутствует. Как оказалось, первые десять остатков глутамата в N-концевой области протромбина карбоксилированы в у-карбоксилелутамот, причем это карбоксилирование осуществляется витамин-К-, зависимой ферментативной системой. Указанную аминокислоту не удавалось выявить вплоть до последнего времени, потому что при кислотном гидролизе происходит потеря у-карбоксигруппы и у-карбоксиглутамат определяется как глу-.
Рис. 8.33. Формулы витамина К2 и двух тамат: его антагонистов-дикумарола и варфарина
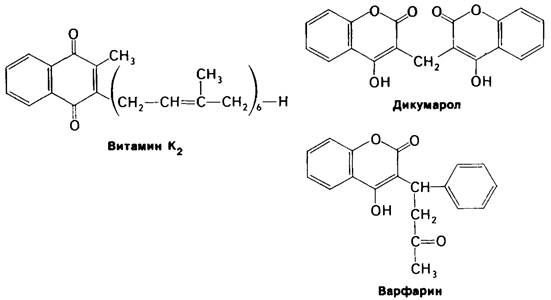
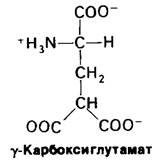
Рис. 8.34. Последовательность аминокислот N-концевой части протромбина [остатки у-карбоксиглутамината (GL) показаны красным]
