БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 2. ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ О СТРУКТУРЕ И ФУНКЦИИ БЕЛКОВ
2.4. Белки состоят из одной или нескольких полипептндных цепей
Многие белки, в частности миоглобин, состоят из одной полипептидной цепи; другие содержат две цепи или более, причем цепи могут быть одинаковыми или разными. Так, молекула гемоглобина построена из 2 цепей одного типа и 2 цепей другого типа; эти четыре цепи связаны между собой нековалентными связями. В некоторых многоцелочечных белках полипептидные цепи соединены дисульфидными мостиками. В инсулине, например, две составляющие его цепи соединены двумя дисульфидными связями.
2.5. Для очистки белков можно использовать множество различных методов
Для выяснения механизма действия белка его необходимо выделить в очищенном виде. В настоящее время в чистом виде получено уже несколько тысяч белков. В процессе выделения и очистки белок отделяют от других белков и от небелковых соединений, исходя из таких его свойств, как размер молекулы, растворимость, заряд, специфическое сродство связывания. Обычно применяют несколько разных методов очистки и сравнивают их эффективность путем определения интересующего белка по какому-то свойству. Например, ферменты определяют по удельной каталитической активности. При этом измеряют также и общее количество белка, что позволяет установить степень очистки данного белка на каждом этапе выделения.
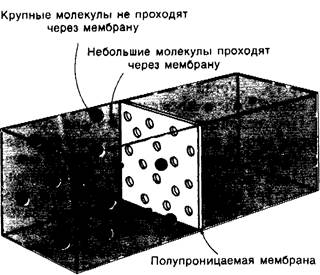
Отделение белков от низкомолекулярных веществ проводят путем диализа через полупроницаемую мембрану (рис. 2.21). Белки, молекулярная масса которых превышает 15 килодальтон (кДа) остаются внутри обычного диализного мешочка, тогда как более мелкие молекулы и ионы проходят через поры диализной мембраны и выходят из мешочка в диализат.
Рис. 2.21. Разделение молекул по размеру путем диализа
Дальтон (Да)- единица массы, практически равная массе атома водорода (т. е. 1,0000 по шкале атомных масс). Терминами «дальтон» и «молекулярная масса» пользуются как взаимозаменяемыми; например, белок в 20 000 дальтон имеет молекулярную массу 20000. Наименование дано в честь Джона Дальтона (1766-1844), разработавшего атомарную теорию строения материи.
Килодальтон (кДа)- единица массы, равная 1000 дальтон. Масса большинства белков лежит в пределах от 10 до 100 кдал.
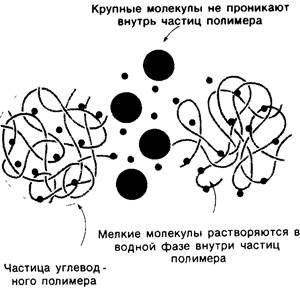
Разделение белков по размеру молекулы проводят также методом гель-фильтрации (рис. 2.22). В этом случае пробу наносят на колонку из нерастворимого, но высокогидратированного углеводного полимера, состоящего из мелких частиц в виде зерен диаметром обычно ОД мм. Обычно используют имеющийся в продаже сефадекс. Небольшие молекулы проникают внутрь частиц полимера, а крупные-нет. В результате низкомолекулярные вещества оказываются в водном растворе как внутри частиц, так и между ними, тогда как высокомолекулярные-в водном растворе только между частицами. Вследствие этого высокомолекулярные вещества, оказавшись в относительно меньшем объеме, быстрее проходят сквозь колонку и первыми снимаются с нее.
Рис. 2.22. Разделение молекул по размеру методом гель-фильтрации
Разделение белков на основе различий в общем заряде осуществляется методом ионообменной хроматографии. Если белок имеет положительный заряд при pH 7, то он обычно связывается на колонке ионообменника, содержащего карбоксильные группы, тогда как отрицательно заряженный белок таким ионообменником не связывается. Такой положительно заряженный белок снимают с колонки путем добавления в элюирующий буфер хлористого натрия или какой-либо другой соли. При этом ионы натрия конкурируют с положительно заряженными группами белков за места связывания на колонке. Те белки, у которых плотность положительного заряда ниже, вымываются с колонки первыми, за ними следуют белки с более высокой плотностью положительного заряда. Помимо общего заряда на поведение белков при ионообменной хроматографии оказывают влияние и другие факторы. Общий заряд белка определяет также и скорость его миграции в электрическом поле. На этом принципе основан метод электрофореза, который мы подробнее обсудим в одной из следующих глав (разд. 5.3). Здесь же стоит отметить высокую разрешающую способность метода электрофореза. Так, используя двумерный электрофорез, удалось получить более 1000 различных фракций при однократном разделении белков такого простого организма, как бактерия E. coli (рис. 2.23).
Рис. 2.23. Двумерный электрофорез белков Е. coli. Метод позволяет выявить более 1000 различных белков этой бактерии. Разделение происходит на основе различий в изоэлектрической точке белков (электрофорез в горизонтальном направлении) и на основе различий в молекулярной массе (вертикальный электрофорез)

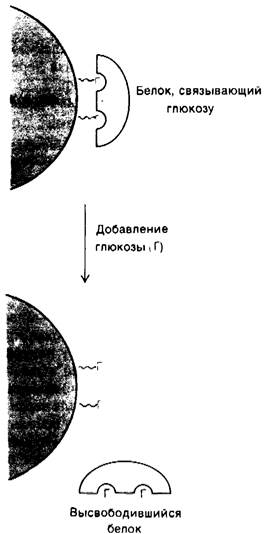
Еще один мощный и универсальный способ очистки белков -хроматография по сродству (аффинная хроматография). В основе метода лежит характерное для многих белков высокое сродство к специфическим химическим группам. В частности, растительный белок конканавалин А можно выделить из неочищенного экстракта, пропуская экстракт через колонку, содержащую ковалентно присоединенную глюкозу. Конканавалин А, обладающий сродством к глюкозе, связывается с колонкой, тогда как остальные белки, как правило, на колонке не адсорбируются. Далее связанный конканавалин А снимают с колонки концентрированным раствором глюкозы. При этом в участках связывания глюкозы в молекулах конканавалина А происходит замещение присоединенных к колонке остатков глюкозы на глюкозу, находящуюся в растворе (рис. 2.24). Итак, с помощью хроматографии по сродству можно выделять белки, которые распознают какую-то группу X; для этого: 1) X или ее производное ковалентно присоединяют к колонке; 2) наносят на колонку белковую смесь и затем не связавшиеся белки удаляют буфером; 3) элюируют искомый белок, добавляя X в виде раствора высокой концентрации.
Рис. 2.24. Хроматография по сродству (аффинная хроматография) конканавалина А (показан желтым) на колонке, содержащей ковалентно присоединенные остатки глюкозы (Г)