БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 10. ВВЕДЕНИЕ В ПРОБЛЕМУ БИОЛОГИЧЕСКИХ МЕМБРАН
10.6. Липидные бислои непроницаемы для ионов и многих полярных молекул
Измерение проницаемости липидных бислоев проводилось в двух четко охарактеризованных искусственных системах: липидных пузырьках и плоских двуслойных мембранах. С помощью этих модельных систем удалось определить основную функцию биологических мембран, а именно их роль непроницаемого барьера. Решающую роль имеет тот факт, что липидные бислои по своей природе оказались непроницаемы для ионов и большинства полярных соединений.
Липидные пузырьки (называемые также липосомами) представляют собой водную фазу, окруженную липидным бислоем (рис. 10.12). Для получения липосом приготовляют суспензию какого-либо подходящего липида, например, фосфатидилхолина, в водной среде. Далее смесь обрабатывают ультразвуком; в результате образуются замкнутые липидные пузырьки одинакового размера. Липидные пузырьки можно также получить, быстро смешивая с водой раствор липидов в этаноле. Этого можно достичь путем введения раствора липидов через тонкую иглу, что приводит к образованию пузырьков почти правильной сферической формы с диаметром около 500 А. Для получения пузырьков большего размера (порядка 104 А, или 1 мкм в диаметре) из суспензии фосфолипидов в смешанной системе растворителей медленно выпаривают органический растворитель.
Рис. 10.12. Схематическое изображение липидного пузырька
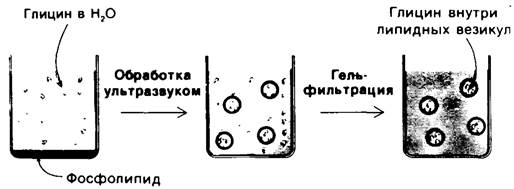
Если получать липосомы в присутствии каких-то растворенных в воде ионов или молекул, то эти вещества окажутся в водной фазе липосом (рис. 10.13). Так, например, если липосомы диаметром 500 А образуются в 0,1 М растворе глицина, то внутри каждой из них окажется примерно 2000 молекул глицина. Такие содержащие глицин липосомы можно отделить от окружающего раствора глицина путем диализа или гель- фильтрации. Если требуется определить проницаемость мембранного бислоя в отношении глицина, то для этого нужно измерить скорость выхода глицина из внутреннего компартмента липосом во внешнюю среду. Липосомы представляют интерес не только в плане изучения проницаемости. Оказалось, что они способны к слиянию с плазматической мембраной различных клеток, а это открывает возможность для введения в клетки самых разнообразных веществ, не способных проникать через мембрану. Избирательное слияние липосом с клетками определенных типов может быть успешно использовано для контролируемой доставки лекарственного вещества к клетке- мишени.
Рис. 10.13. Приготовление суспензии липидных пузырьков, содержащих молекулы глицина
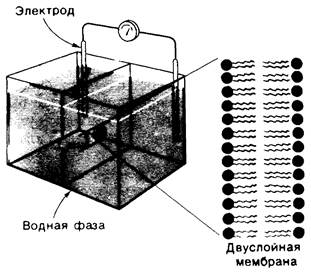
Второй тип искусственной мембраны — плоская двуслойная мембрана (или мембранный бислой). Получают эту структуру, используя отверстие размером 1 мм в перегородке между двумя водными растворами. Такая мембрана очень удобна для изучения электрических явлений в силу большого размера и простой формы. Способ получения больших двуслойных мембран разработали Поль Мюллер и Доналд Рудин (Р. Mueller, D, Rudin). В раствор липида, из которого хотят получить мембрану, например, в раствор фосфатидилхолина в декане, опускают тоненькую кисточку. Затем концом кисточки делают взмах через отверстие (диаметром 1 мм) в перегородке между двумя водными растворами. В результате отверстие перегораживается спонтанно образовавшейся тонкой липидной пленкой; избыток липидов скапливается по краям отверстия. Формирование плоской двуслойной мембраны из фосфатидилхолина занимает несколько минут. Нетрудно определить электропроводность такого макроскопического бислоя, поместив электроды в водную фазу по обе стороны мембраны (рис. 10.14). Можно определить, например, и ионную проницаемость мембраны, измеряя величину проходящего через нее тока в зависимости от приложенного напряжения.
Рис. 10.14. Экспериментальная установка для изучения плоских двуслойных мембран. Двуслойная мембрана образуется таким образом, что затягивает собой отверстие диаметром 1 мм в перегородке, разделяющей две водные фазы
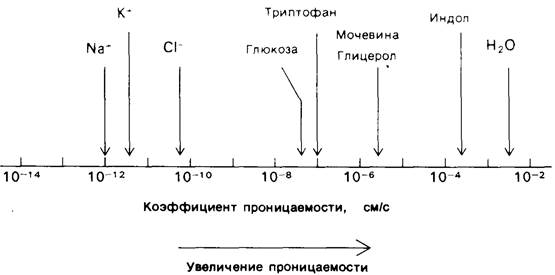
Исследование проницаемости мембранных пузырьков и электропроводности плоских бислоев показало, что липидная двуслойная мембрана обладает очень малой проницаемостью для ионов и большинства полярных молекул. Исключение из правила составляет вода, проникающая через такие мембраны. Экспериментально полученные коэффициенты проницаемости варьируют в широких пределах (рис. 10.15). Так, Na + и К + проходят через мембраны в 109 раз медленнее, чем вода. Триптофан, который при pH 7 является биполярным ионом, проходит через мембраны в 103 раз медленнее, чем индол, который сходен с триптофаном по структуре, но не несет ионизированных групп. Коэффициенты проницаемости для низкомолекулярных соединений коррелируют с отношением их растворимости в неполярных растворителях к растворимости в воде. Эта зависимость дает основание думать, что низкомолекулярные соединения проходят сквозь двуслойную мембрану следующим образом: сначала они теряют окружающую их гидратную оболочку, затем растворяются в углеводородном внутреннем слое мембраны, наконец диффундируют через этот внутренний слой к другой стороне мембраны, где вновь растворяются в воде.
Рис. 10.15. Коэффициенты проницаемости липидных двуслойных мембран для некоторых ионов и молекул
10.7. Большинство мембранных процессов опосредовано белками
Обратимся теперь к мембранным белкам, ответственным за большинство динамических процессов, осуществляемых мембранами. Мембранные липиды создают барьеры проницаемости и тем самым отграничивают отдельные участки (компартменты), тогда как специфические белки опосредуют отдельные функции мембран, такие, как транспорт, передачу информации и преобразование энергии. При этом мембранные липиды создают среду, необходимую для действия этих белков.
Мембраны различаются между собой по содержанию белка. Так, в миелине, который служит изолирующей оболочкой многих нервных волокон, содержится мало белка (18%). Основной компонент миелина-липид с прекрасными изоляционными свойствами. С другой стороны, в большинстве клеток плазматические мембраны обладают значительно более высокой активностью и содержат различные насосы, каналы, рецепторы, ферменты. Количество белка в таких плазматических мембранах достигает, как правило, 50%. Наиболее высоким содержанием белка, вплоть до 75%, характеризуются мембраны, функционирующие как преобразователи энергии, в частности внутренние мембраны митохондрий и хлоропластов.
С помощью электрофореза в полиакриламидном геле с додецилсулъфатом натрия (ДСН) удается выявить основные мембранные белки.
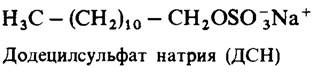
При использовании этого метода мембраны сначала солюбилизируют 1%-ным раствором ДСН. Этот детергент разрушает большинство белок-белковых и белок-липидных связей. Далее полученный раствор наслаивают на полиакриламидный гель, также содержащий ДСН, и все это помещают на несколько часов в электрическое поле. В этой системе в отличие от других, не содержащих ДСН, электрофоретическая подвижность большинства белков зависит от их массы, а не от заряда. Дело в том, что отрицательный заряд молекул ДСН, присоединенных к белку, намного превышает общий заряд самого белка. Полосы разделившихся белковых фракций проявляют, обрабатывая гель краской типа кумасси синий. При этом выявляются крайне малые количества белка - порядка нескольких микрограммов. На рис. 10.16 показаны результаты гель-электрофореза трех мембран — плазматической мембраны эритроцитов, фоторецепторной мембраны палочек сетчатки и мембраны саркоплазматического ретикулума мышцы. Отчетливо видно, что белковый состав этих трех мембран совершенно разный. Кроме того, мембраны различаются по набору входящих в их состав полипептидных цепей и по распределению массы. Таким образом, мембраны, выполняющие неодинаковые функции, различаются также по белковому составу.
Рис. 10.16. Электрофореграммы различных мембран в ДСН-полиакриламидном геле. A-плазматическая мембрана эритроцитов. Б - мембранные диски палочек сетчатки. В - мембраны саркоплазматического ретикулума мышечных клеток
