БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 10. ВВЕДЕНИЕ В ПРОБЛЕМУ БИОЛОГИЧЕСКИХ МЕМБРАН
10.11. Мембрану эритроцита пронизывают канал для анионов и сложный белок гликофорин
В мембране эритроцитов имеется анионный канал, делающий мембрану проницаемой для НСО3- и Сl-. Быстрый обмен этих ионов через мембрану имеет большое значение для транспорта СO2 эритроцитами. Как было показано относительно недавно, анионный канал-это димер белка, представленного при электрофорезе полосой 3; он составляет одну четверть общего количества белка в эритроцитарной мембране. Масса димера 95 кДа. Для определения локализации и ориентации белка полосы 3 использовали следующий прием: интактные эритроциты, разорванные тени и вывернутые наружу мембранные везикулы подвергали протеолитическому действию химотрипсина. Результат протеолиза зависел от того, что было доступно действию химотрипсина: наружная или внутренняя поверхность мембран или же обе поверхности сразу. Эти опыты показали, что белок полосы 3 локализован на обеих сторонах эритроцитарной мембраны и все молекулы белка одинаково ориентированы (рис. 10.23). Оказалось, также, что углеводный компонент белка расположен на наружной поверхности. Трансмембранная локализация белка полосы 3 вполне
соответствует его функции канала через мембрану.
Рис. 10.23. Схема расположения белка полосы 3 (анионный канал) в мембране эритроцита
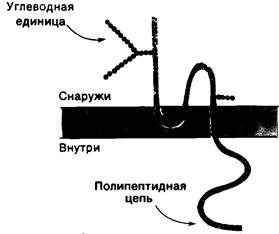
Еще один хорошо изученный трансмембранный белок эритроцитов - это гликофорин А, состоящий из 16 олигосахаридных единиц, прикрепленных к единственной полипептидной цепи. На долю углеводов приходится 60% массы этого белка, так что его название (образованное от греческого «нести сахар») вполне заслуженно. Из-за высокого содержания углеводов гликофорин интенсивно окрашивается РАS-реактивом.
Этот белок составляет полосу РАS-1. Исследования с применением протеолиза, химической модификации, а также электронной микроскопии показали, что гликофорин А состоит из трех доменов: 1) N-концевой области, содержащей все углеводные единицы и локализованной на наружной стороне мембраны; 2) гидрофобного срединного участка, погруженного в углеводный слой мембраны, и 3) С-концевой области, содержащей много полярных и ионизированных боковых цепей и расположенной на внутренней стороне эритроцитарной мембраны (рис. 10.24). Несмотря на большое количество данных о структуре гликофорина, функция его остается неизвестной.
10.12. Углеводные единицы расположены на наружной стороне плазматической мембраны
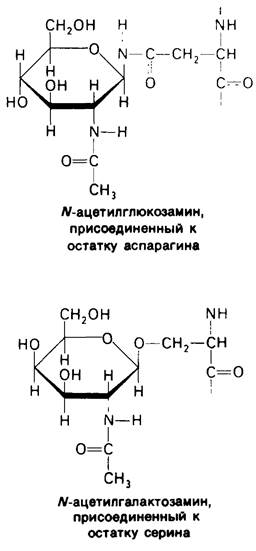
В клеточных мембранах эукариот содержится от 2 до 10% углеводов в форме гликолипидов и гликопротеинов. Как было сказано выше (разд. 10.3), гликолипиды высших организмов представлены производными сфингозина с одним или более остатками сахара. В мембранных гликопротеинах одна или несколько углеводных цепей присоединены к боковым цепям серина, треонина или аспарагина (обычно через N-ацетилглюкозамин или N-ацетилгалактозамин). Локализацию этих углеводных групп в мембране определяют путем использования специфической метки. Подходящей меткой оказались лектины- растительные белки, обладающие высоким сродством к специфическим углеводным остаткам. Например, конканавалин А присоединяется к внутренним и нередуцирующим концевым остаткам а!!!-маннозы, тогда как агглютинин из зародыша пшеницы присоединяется к концевым остаткам N- ацетилглюкозамина. Эти лектины хорошо видны в электронном микроскопе, когда они соединены с ферритином - белком, содержащим гидроксид железа и потому обладающим высокой электронной плотностью. Оказалось, что конъюгат конкана- валина А с ферритином специфически связывается на наружной, но не на внутренней поверхности мембраны эритроцитов. Такая же асимметрия наблюдалась и в отношении связывания многих других лектинов мембранами различных клеток. Таким образом, наружная локализация углеводных единиц анионного канала и гликофорина (рис. 10.23 и 10.24) отражает общий принцип строения мембран, а именно: остатки сахаров локализованы на наружной поверхности плазматической мембраны. Во всех исследованных к настоящему времени клетках млекопитающих остатки сахаров в плазматических мембранах локализованы только на наружной стороне мембраны (рис. 10.25).
Возможно, что углеводные группы служат для ориентирования гликопротеинов в мембране. Обладая ярко выраженными гидрофильными свойствами, остатки сахаров в гликопротеинах или гликолипидах должны располагаться на поверхности мембраны, а не в ее углеводородной сердцевине. Энергетическая цена встраивания олигосахаридной цепи в углеводородное окружение внутри мембраны очень высока. Стало быть, существует барьер, препятствующий свободному вращению гликопротеина от одной стороны мембраны к другой. Углеводные компоненты мембранных гликопротеинов способствуют поддержанию асимметрии биологических мембран.
Рис. 10.24. Последовательность аминокислот и трансмембранная локализация гликофорина А из эритроцитов. 15 углеводных единиц, присоединенных к остаткам серина и треонина, показаны светло-зеленым, а одна углеводная единица, присоединенная к боковой цепи аспарагина, темно-зеленым. Гидрофобные аминокислотные остатки, погруженные в бислой, выделены желтым. С-концевая часть молекулы белка, расположенная внутри клетки, несет много отрицательно заряженных
(красные) и положительно заряженных (синие) аминокислотных остатков. В числе углеводных единиц в N-концевой части белковой молекулы, лежащей вне клетки, много отрицательно заряженных групп сиаловой кислоты
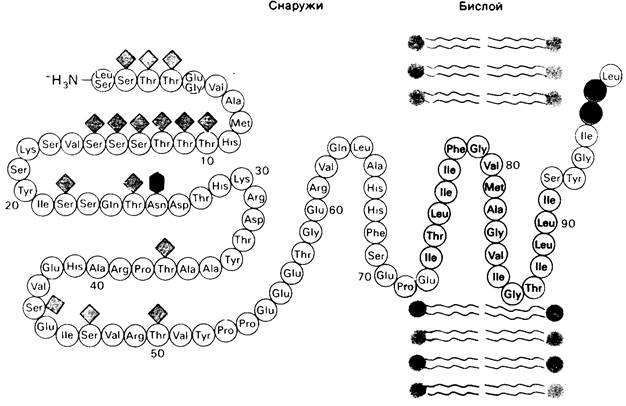
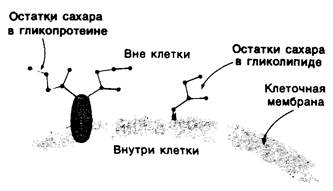
Рис. 10.25. Углеводные остатки гликолипидов и гликопротеинов как правило, локализованы на наружной поверхности плазматических мембран клеток млекопитающих
Углеводы на поверхности клетки могут играть также важную роль в межклеточном узнавании. От узнавания клетками друг друга зависят такие, например, процессы, как формирование тканей путем взаимодействия различных клеток или распознавание чужеродных клеток иммунной системой высших организмов. Углеводы обладают потенциальной возможностью к созданию огромного структурного разнообразия. Так, набор углеводов на поверхности клеток имеет колоссальное число вариантов потому, что: 1) моносахариды могут соединяться друг с другом через любой из своих гидроксилов; 2) связь по С-1 может быть, как α-, так и β-конфигурации и 3) возможно интенсивное ветвление цепи. В самом деле, из четырех сахаров может образоваться гораздо больше разных олигосахаров, чем из четырех аминокислот-разных олигопептидов.