БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 10. ВВЕДЕНИЕ В ПРОБЛЕМУ БИОЛОГИЧЕСКИХ МЕМБРАН
10.18. Трехмерная модель мембран по данным электронной микроскопии
Как мы видели на примерах переносчиков кислорода и ферментов, описанных в предыдущих главах, рентгеноструктурный анализ является надежным методом изучения трехмерной структуры растворимых белков. Применим ли рентгеноструктурный анализ к мембранным белкам? Трудность заключается в том, что до сих пор не удавалось получить интегральных белков мембраны в виде трехмерных кристаллов. Однако некоторые мембранные белки образуют правильную решетку в плоскости мембраны, т. е. двумерные кристаллы. Структурный анализ этих кристаллоидных форм удается осуществить с помощью электронной микроскопии; в частности, такое исследование было с успехом проведено на пурпурной мембране Нalobacterium halobium - бактерии, обитающей в соленой среде. Пурпурная мембрана-это специализированная область клеточной мембраны, содержащая бактериородопсин - белок массой 25 кДа, который превращает энергию света в трансмембранный протонный градиент, используемый для синтеза АТР (разд. 19.21). Были получены кристаллоиды в виде листка, или диска, диаметром до 1 мкм. Благодаря тому, что в каждом из них содержалось около 20000 молекул бактериородопсина, можно было получить изображение, используя очень слабый пучок электронов и тем самым сводя к минимуму радиационные повреждения. Кроме того, для получения изображения с высокой степенью разрешения можно было брать неокрашенные препараты. Одно электронно-микроскопическое изображение кристаллоидного листка пурпурной мембраны дает вид структуры, спроецированной на плоскость. Следующий этап-получение изображений последовательных срезов и обработка информации, заключенной примерно в 20 снимках, методом рядов Фурье.
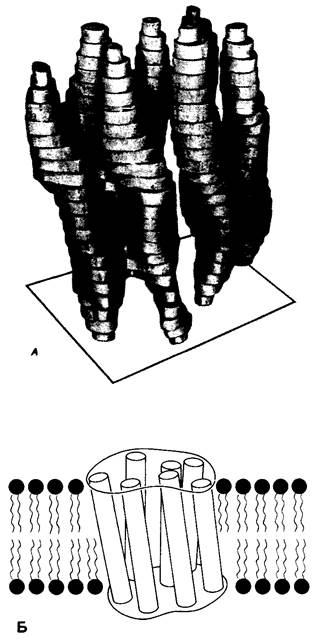
Используя описанный подход, Ричард Хендерсон и Нигел Ануин (R. Henderson, N. Unwin) сконструировали трехмерную модель пурпурной мембраны с разрешением 7 А (рис. 10.32). Белки этой мембраны содержат семь плотно упакованных а-спиралей, которые идут почти перпендикулярно плоскости, мембраны, занимая по ширине около 45 А. Пространство между молекулами белка заполнено липидным бислоем. Вполне вероятно, что принцип структурной организации пурпурной мембраны использован и в организации других интегральных белков. Предполагается, в частности, что мембранные насосы и каналы содержат α- спирализованные участки, пронизывающие бислой.
Рис. 10.32. А -модель бактериородопсина, сконструированная по данным трехмерной карты с разрешением 7 А. Б-схема для пояснения; показано размещение α-спирализованных участков в липидном бислое. Связи между этими спиралями в настоящее время еще не определены