БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 21. БИОСИНТЕЗ АМИНОКИСЛОТ И ГЕМА
21.10. Гистидин синтезируется из АТР, ФРГТФ и глутамина
Пути биосинтеза гистидина в клетках E.coli и Salmonella обладают многими сложными и новыми для нас особенностями. Последовательность реакций начинается с конденсации АТР и ФРПФ, при которой N-1 пуринового кольца связывается с С-1 рибозной группы ФРПФ. Что касается готовой молекулы, то пять атомов углерода гистидина происходят из ФРПФ. Адениновый остаток АТР дает азот и один углеродный атом имидазольного кольца гистидина. Второй атом азота имидазольного кольца происходит из боковой цепи глутамина. Важная особенность этого пути состоит в том, что рибонуклеотид 5-аминои- мидазол-4-карбоксамида, образующийся при реакции расщепления с образованием имидазольного кольца, служит промежуточным продуктом в биосинтезе пуринов (разд. 22.4). Таким образом, пути биосинтеза гистидина и пуринов оказываются взаимосвязанными.
21.11. Биосинтез аминокислот регулируется ингибированием конечным продуктом
Скорость синтеза аминокислот зависит главным образом от количества ферментов биосинтеза и от их ферментативной активности. Перейдем теперь к регуляции ферментативной активности. Регуляция синтеза ферментов будет обсуждаться в гл. 28.
Первая необратимая реакция пути биосинтеза, которая называется направляющей реакцией, или решающим этапом (решающей реакцией), обычно важный участок регуляции. Конечный продукт пути (Z) часто ингибирует фермент, катализирующий первую решающую реакцию (А → В).
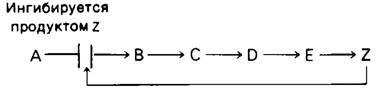
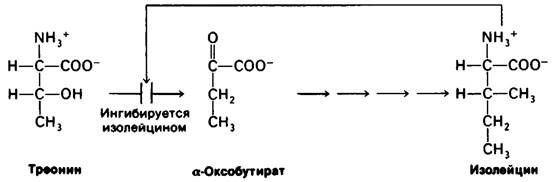
Регуляция такого рода необходима для сохранения строительных блоков и метаболической энергии. Первый пример этого важного принципа регуляции метаболизма был обнаружен при изучении биосинтеза изолейцина в клетках Е.соli. Дегидратация и дезаминирование треонина с образованием α-оксобутирата - решающая реакция в синтезе изолейцина. Катализирующий эту реакцию пиридоксалевый фермент треонин- дезаминаза аллостерически ингибируется изолейцином.
Подобно этому, триптофан ингибирует ферментный комплекс, катализирующий первые две стадии превращения хоризмата в триптофан.
Рассмотрим разветвляющийся биосинтетический путь, конечные продукты которого У и Z.
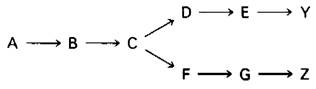
Предположим, что высокая концентрация У или Z полностью ингибирует первую общую стадию (А → В). Тогда при высокой концентрации У будет подавлен ситез Z, даже если его содержание ниже необходимого уровня. Очевидно, такая схема регуляции не оптимальна. В действительности в разветвленных биосинтетических путях было обнаружено несколько тонких регуляторных механизмов.
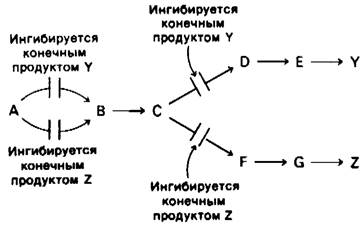
1. Последовательная регуляция по принципу обратной связи. Первая общая реакция (А → В) непосредственно не ингибируется продуктами У или Z. Вместо этого конечные продукты ингибируют начальные реакции каждой из ветвей: У ингибирует реакцию С → D, а Z-реакцию С → F. Высокая концентрация С в свою очередь ингибирует реакцию А → В. Таким образом, первая общая реакция блокируется только в том случае, если оба конечных продукта присутствуют в избытке.
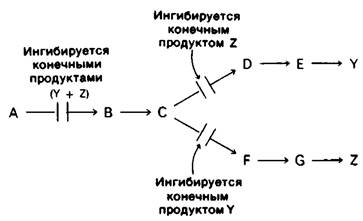
Последовательная регуляция конечным продуктом действует при синтезе ароматических аминокислот в клетках Bacillus subtilis. Первые реакции после разветвления общего пути биосинтеза фенилаланина, тирозина и триптофана ингибируются соответствующими конечными продуктами.
Если все три продукта присутствуют в избытке, происходит накопление хоризмата и префената. Эти промежуточные продукты, синтезирующиеся в реакциях перед точкой разветвления путей, в свою очередь ингибируют первую общую реакцию всего биосинтетического пути - конденсацию фосфоенолпирувата и эритрозо-4-фосфата.
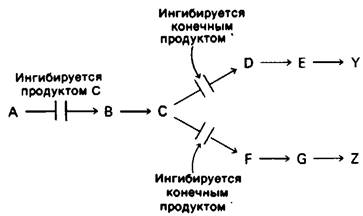
2. Множественность ферментов. Отличительное свойство этого механизма то, что первая общая реакция (А → В) катализируется двумя различными ферментами. Один из них ингибируется продуктом У, а другой - продуктом Z. Таким образом, чтобы полностью предотвратить превращение А в В, концентрации и У, и Z должны быть высокими. Кроме того, при такой схеме регуляции, как и при последовательной регуляции по типу обратной связи, У ингибирует реакцию С → D), а Z-реакцию С → F
Дифференциальное ингибирование множества ферментов используется для регуляции многочисленных метаболических путей у микроорганизмов. У Е. coli конденсация фосфоенолпирувата и эритрозо-4-фосфата катализируется тремя различными ферментами. Один из них ингибируется фенилаланином, другой-тирозином и третий-триптофаном. Кроме того, существуют две различные мутазы, превращающие хоризмат в префенат. Одна из них ингибируется фенилаланином, другая - тирозином.
3. Согласованная регуляция по типу обратной связи. Первая общая реакция (А → В) ингибируется только в том случае, если и У, и Z одновременно присутствуют в высокой концентрации. При высокой концентрации лишь одного (любого) из этих продуктов ингибирования реакции А → В не происходит. Как и в первых двух схемах регуляции, У ингибирует реакцию С → D, а Z- реакцию С → F.
Пример согласованной регуляции по типу обратной связи — ингибирование аспартил- киназы конечными продуктами треонином и лизином.
4. Кумулятивная регуляция по типу обратной связи. Первая общая реакция (А → В) частично ингибируется каждым из конечных продуктов. Каждый конечный продукт действует независимо от других. Предположим, при высокой концентрации У скорость реакции А → В снижается от 100 до 60 с-1, a Z снижает скорость от 100 до 40 с-1. Тогда скорость реакции А →В в присутствии высоких концентраций У и Z будет 24 с-1 (0,6 • 0,4 • 102 с-1).
21.12. Активность глутамин-синтетазы регулируется путем аденилирования
Регуляция глутамин-синтетазы Е coli-впечатляющий пример кумулятивного ингибирования по типу обратной связи. Напомним, что глутамин синтезируется из глутамата, NH4+ и АТР (разд. 21.2). Глутамин-синтетаза состоит из 12 субъединиц с мол. массой 50 кДа каждая, уложенных в два параллельных гексагональных кольца (рис. 21.15). Этот фермент - ключевой регуляторный элемент метаболизма, поскольку он, как показали Эрл Стэдтман (Earl Stadtman) и его коллеги, регулирует поток азота. Амидная группа глутамина - источник азота в биосинтезе ряда соединений, например, триптофана, гистидина, карбамоилфосфата, глюкозамин-6- фосфата, СТР и АМР. Глутамин-синтетаза кумулятивно ингибируется каждым из этих конечных продуктов метаболизма глутамина, а также аланином и глицином. Видимо, в молекуле этого фермента имеются участки связывания для каждого из этих ингибиторов. Ферментативная активность глутамин-синтетазы почти полностью подавляется при связывании всех восьми конечных продуктов.
Рис. 21.15. Вид на глутамин-синтетазу Е. coli в трех проекциях. Изображения получены путем наложения большого числа электронных микрофотографий. Двенадцать субъединиц уложены в два гексагональных кольца, расположенных в параллельных плоскостях

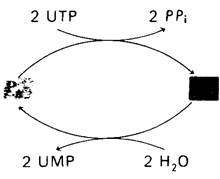
Еще одно важное свойство глутамин-синтетазы - обратимая ковалентная модификация, изменяющая ее активность (рис. 21.16). Мы уже встречались с таким механизмом регуляции при синтезе и распаде гликогена (разд, 16.11). Фосфорилирование активирует гликоген-фосфорилазу и инактивирует гликоген-синтазу. Активность глутамин-синтетазы регулируется в некоторой степени ковалентным присоединением остатка АМР к гидроксильной группе специфического остатка тирозина в каждой субъединице. Такой аденилированный фермент более чувствителен к кумулятивному ингибированию по типу обратной связи, чем неаденилированный фермент. Остаток АМР, ковалентно присоединенный к ферменту, может быть удален с помощью фосфоролиза. Любопытная особенность этих реакций состоит в том, что они катализируются одним и тем же ферментом, аденилилтрансферазой. Чем же определяется, присоединяет ли этот фермент остаток АМР или отщепляет его? Оказалось, что специфичность аденилилтрансфе- разы контролируется регуляторным белком (он обозначается буквой Р), который может существовать в двух формах: РA и РD- Комплекс РA—аденилаттрансфераза присоединяет АМР к глутамин-синтазе и тем самым снижает ее активность, тогда как комплекс PD—аденилаттрансфераза отщепляет АМР. Итак, мы столкнулись с еще одним уровнем обратимой ковалентной модификации. РD превращается в PD путем присоединения уридинмонофосфата (UMP) (рис. 21.17). Эта реакция, которая катализируется уридил- трансферазой, стимулируется АТР и α-оксо- глутаратом и ингибируется глутамином. Остаток UMP, присоединенный к PD, может быть в свою очередь удален ферментативным гидролизом.
21.16. Регуляция активности глутамин-синтетазы с помощью обратимой ковалентной модификации. Аденилирование катализируется комплексом аденилилтрансферазы (АТ) и одной из форм регуляторного белка (РА). Тот же фермент в комплексе с другой формой регуляторного белка (РD) катализирует деаденилирование
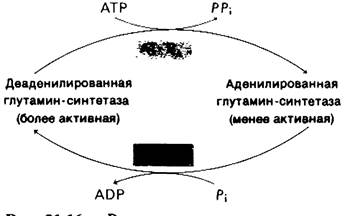
Рис. 21.17. Более высокий уровень каскадной регуляции глутамин- синтетазы. Регуляторные белки РА и РD, определяющие специфичность глутамин-синтетазы, способны к взаимопревращениям. РА превращается в РD путем уридилирования (присоединения остатка UМР). Обратная реакция происходит путем гидролиза. Ферменты, катализирующие эти реакции, «чувствуют» концентрации промежуточных продуктов метаболизма
В результате этого регуляторного каскада при ограниченном поступлении активированных атомов азота аденилирование ингибируется, а деаденилирование стимулируется. Глутамин-синтетаза становится менее чувствительной к кумулятивному ингибированию по типу обратной связи, и поступление глутамина соответственно увеличивается. Почему для регуляции этого фермента используется каскадный механизм? Одно из преимуществ этого механизма состоит в том, что он усиливает сигналы, как, например, при свертывании крови (разд. 8.17) или при регуляции метаболизма гликогена (разд. 16.17). Еще одна причина состоит, видимо, в том, что существенно возрастает возможность аллостерического контроля, так как каждый фермент каскада становится независимым объектом регуляции. Для интеграции метаболизма азота в клетке необходимо воспринимать и перерабатывать большое количество сигналов. Возможности одного белка в этом смысле ограничены, даже если молекула настолько чувствительна, как молекула глутамин-синтетазы! Возникновение каскадной регуляции обеспечило много дополнительных регуляторных участков и позволило тонко настраивать поток азота в клетке.