БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 21. БИОСИНТЕЗ АМИНОКИСЛОТ И ГЕМА
21.13. Аминокислоты - предшественники множества других биомолекул
Аминокислоты-строительные блоки белков и пептидов. Они служат также предшественниками многих малых молекул, играющих важную биологическую роль. Рассмотрим вкратце некоторые молекулы, синтезирующиеся из аминокислот (рис. 21.19). Пурины и пиримидины происходят частично из аминокислот. Биосинтез этих предшественников ДНК, РНК и многих коферментов будет подробно обсуждаться в следующей главе. Шесть из девяти атомов пуриновых колец и четыре из шести атомов пиримидинового кольца происходят из аминокислот. Реакционноспособная концевая группировка сфингозина, промежуточного продукта в синтезе сфинголипидов, происходит из серина. Гистамин, вызывающий сильное расширение сосудов, образуется из гистидина путем декарбоксилирования. Тирозин- предшественник гормонов тироксина (тетраиодтиронина), а также адреналина и меланина, полимерного пигмента. Нейромедиатор 5-гидрокситриптамин (серотонин) и никотинамидное кольцо NAD+ синтезируются из триптофана. Глутамин поставляет амидогруппу для остатка никотинамида.
Рис. 21.18. Модель глутамин-синтетазы. Показаны периферические участки аденилирования
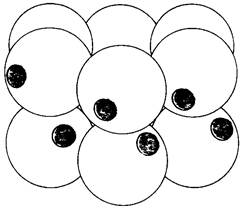
Рис. 21.19. Биомолекулы, образующиеся из аминокислот
21.14. Порфнрины синтезируются из глицина и сукцинил-СоА
Участие аминокислот в биосинтезе порфи- риновых колец гемов и хлорофиллов было вначале открыто в экспериментах по введению изотопной метки, проведенных Дэвидом Шемином (David Shemin) и его коллегами. В 1945 г. они показали, что после введения людям с пищей 15N-глицина в молекуле гема обнаруживается 15N, однако после введения 15N-глутамата включение метки оказывается незначительным. С помощью углерода-14, который как раз к этому времени стал доступен для исследователей, они установили, что в ядерных эритроцитах уток 8 углеродных атомов гема происходят из α-углерода глицина; ни один атом не происходит из карбоксильных углеродов. Дальнейшие исследования показали, что остальные 26 атомов гема могут происходить из ацетата. Более того, атомы 14С меченного по метальной группе ацетата обнаруживаются в виде 24 из 26 атомов углерода гема, а атомы 14С из ацетата, меченного по карбоксилу, обнаруживаются только в двух других атомах. Таким образом, в результате проведенного эксперимента была обнаружена четкая картина распределения метки, на основе которой Шемин высказал предположение, что предшественник гема образуется путем конденсации глицина с активированным соединением сукцината. Действительно, первый этап биосинтеза порфиринов- конденсация глицина и сукцинил-СоА с образованием δ-аминолевулината.
Эта реакция катализируется 6-аминолевулинат-синтазой, пиридоксалевым ферментом митохондрий. Как и следовало ожидать, эта решающая реакция в биосинтезе порфиринов регулируется. Затем две молекулы 8-аминолевулината конденсируются с образованием порфобилииогена. Эта реакция дегидратации катализируется δ-амино- левулинат-дегидратазой.
Четыре молекулы порфобилииогена конденсируются по типу «голова к хвосту», образуя линейный тетрапиррол, который остается связанным с ферментом (рис. 21.21). На каждый образовавшийся метиленовый мостик высвобождается один ион аммония. Этот линейный тетрапиррол циклизуется, теряя NH4+. Циклический продукт - уропорфириноген III, в котором укладка боковых цепей асимметрична. В этих реакциях участвуют синтетаза и косынтетаза. В присутствии одной синтетазы образуется симметричный продукт уропорфириноген I. Косинтетаза необходима для изомеризации одного из пиррольных колец и образования асимметричного уропорфириногена III.
Рис. 21.21. Путь синтеза гема из порфобилиногена. (Сокращения: А-ацетат; М-метил; П -пропионат; В-винил.)
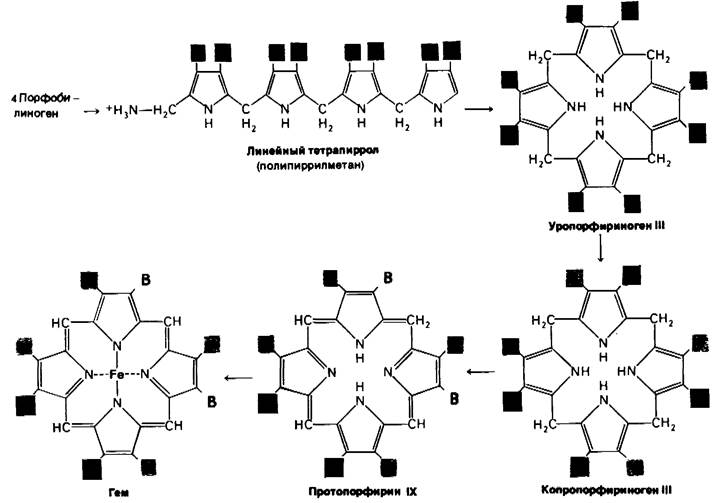
Теперь скелет порфирина готов. Последующие реакции модифицируют его боковые цепи и повышают его непредельность (рис. 21.21). Копропорфириноген 111 образуется при декарбоксилировании боковых ацетатных цепей. После образования двойных связей в порфириновом кольце и превращения двух боковых цепей пропио-
новой кислоты в винильные группы возникает протопорфирин IX. Наконец, после хелатирования железа образуется гем-простетическая группа таких белков, как миоглобин, гемоглобин, каталаза, пероксидаза и цитохром с. Связывание ферроформы железа катализируется феррохелатазой. Железо переносится в плазме крови тражферрином - белком, связывающим два ферри- иона, и запасается в тканях внутри молекул ферритина. Большая внутренняя полость этого белка (диаметр около 80 А) может содержать до 4500 ферри-ионов.
Было выявлено несколько факторов, регулирующих биосинтез гема у животных. 5- Аминолевулинат-синтаза, фермент, катализирующий первую решающую реакцию этого биосинтетического пути, ингибируется по типу обратной связи гемом, так же как 6- аминолевулинат-дегидратаза и феррохелатаза. Кроме того, регуляторные механизмы действуют и на уровне синтеза ферментов.
Гем подавляет синтез b-аминолевулинат- синтазы. Недавние исследования позволяют предположить, что атом железа сам по себе может быть существенным фактором регуляции.
21.15. При некоторых наследственных нарушениях метаболизма порфиринов происходит их накопление
Известно несколько наследственных нарушений метаболизма порфиринов. При врожденной эритропоетической порфирии понижена активность косинтетазы уропорфири- ногена III, изомеразы, катализирующей образование асимметричного изомера при циклизации линейного тетрапиррола. Для синтеза необходимого количества уропорфириногена III организм вынужден накапливать огромные количества уропорфириногена I, симметричного изомера, лишенного какой-либо физиологической роли. Кроме того, накапливаются уропорфирин I, копропорфирин I и другие симметричные производные. При этом заболевании происходит преждевременное разрушение эритроцитов. Болезнь наследуется как аутосомный рецессивный признак. Моча больных окрашена в красный цвет из-за выделения большого количества уропорфирина I. Зубы больных флуоресцируют ярко-красным светом в ультрафиолетовом свете из-за отложения порфиринов. Кроме того, их кожа обычно очень чувствительна к свету.
Острая перемежающаяся порфирия - заболевание совсем другого характера. Оно поражает не эритроциты, а клетки печени, и кожа больных обычно нечувствительна к свету. Эта болезнь обусловлена снижением активности уропорфириноген-синтазы и сопровождается компенсаторным увеличением активности δ-аминолевулинат-син- тазы. Вследствие этого концентрации б-аминолевулината и порфобилиногена в печени увеличены, и большое количество этих соединений выводится с мочой. Острая перемежающаяся порфирия наследуется как аутосомный доминантный признак. Характерные клинические симптомы-перемежающиеся боли в животе и неврологические нарушения. Как показывает название заболевания, клинические проявления носят эпизодический характер. Острые приступы иногда удается подавить с помощью таких лекарств, как барбитураты и эстрогены.
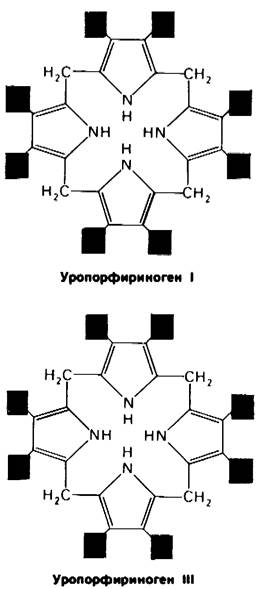
Рис. 21.22. Пространственная модель протопорфирина IX, непосредственного предшественника гема

21.16. Биливердин и билирубин- промежуточные продукты распада гема
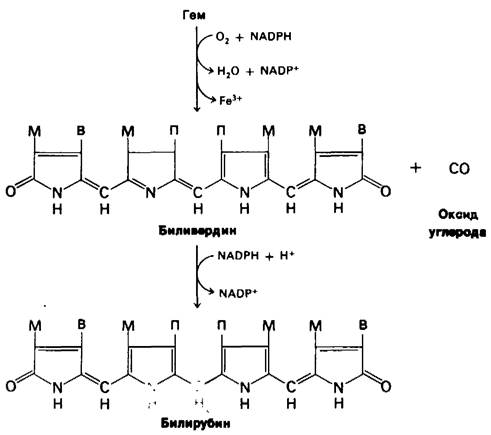
Эритроциты человека в норме живут примерно 120 дней. Старые клетки удаляются из кровеносной системы и распадаются в селезенке. Глобин гидролизуется до составляющих аминокислот. Первая реакция превращения группы гема в билирубин (рис. 21.23)-расщепление α-метенилового мостика с образованием линейного тетрапиррола биливердина. Эту реакцию катализирует гем-оксигеназа. Следует отметить две особенности этой реакции. Во-первых, фермент, катализирующий эту реакцию, монооксигеназа: для расщепления необходимы О2 и NАDРН. Во-вторых, углерод метенилового мостика высвобождается в виде оксида углерода. Этот путь эндогенного образования связан с особой проблемой, касающейся эволюции переносчиков кислорода (разд. 3.7). Затем центральный метениловый мостик биливердина восстанавливается под действием биливердин-редуктазы с образованием билирубина. И в этой реакции восстановителем служит NADPH. Изменения цвета синяков - наиболее наглядное проявление этих реакций расщепления.
Рис. 21.23. Расщепление гема до билирубина
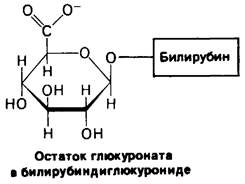
Билирубин в комплексе с сывороточным альбумином переносится в печень, где он переводится в более растворимое состояние благодаря присоединению остатков сахара к его пропионатным боковым цепям. Эти со- любилизирующие остатки сахара представляют собой глюкуроповую кислоту, которая отличается от глюкозы тем, что имеет в положении С-6 группу СОО-, а не СН2ОН. Конъюгат билирубина и двух молекул глюкуроната, называемый диглюкуронидом билирубина, выделяется с желчью. UDP-глюку- ронат образуется при окислении UDP-глюкозы.Это-активированный промежуточный продукт синтеза диглюкуронида билирубина. Таким образом, атом железа гема вновь включается в цикл превращений, а органический остаток превращается в растворимую форму с разомкнутой цепью, которая выводится из организма.