БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 22. БИОСИНТЕЗ НУКЛЕОТИДОВ
22.11. Нуклеозидмоно-, нуклеозидди- и нуклеозид трифосфаты способны к взаимопревращениям
Активная форма нуклеотидов в биосинтетических и энергетических реакциях -дифосфаты и трифосфаты. Нуклеозидмоно- фосфаты фосфорилируются под действием специфических нуклеозидмонофосфаткиназ, использующих в качестве донора фосфатной группы АТР. Например, UMP фосфорилируется под действием UMP-киназы:
UMP + АТР ⇄ UDP + ADP.
AMP, ADP и АТР превращаются друг в друга под действием аденилаткиназы (называемой также миокиназой). Константа равновесия этих реакций близка к I:
АМР + АТР и ADP + ADP.
Нуклеозиддифосфаты и нуклеозидтри- фосфаты превращаются друг в друга под действием нуклеозид-дифосфат — киназы, фермента с широкой специфичностью, в отличие от монофосфаткиназ. В следующих уравнениях X и Y могут быть любыми рибо- или дезоксирибонуклеозидами из большого набора этих соединений:
XDP + УТР ⇄ ХТР + YDP.
Например,
UDP + ADP ⇄ UTP + ADP.
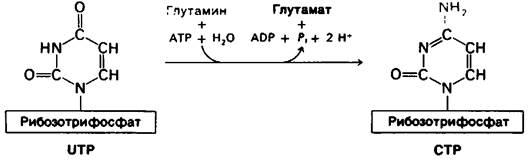
22.12. СТР образуется путем аминирования UTP
Цитидинтрифосфат (СТР) образуется из другого основного пиримидинрибонуклео- тида, уридинтрифосфата (UTP). Карбонильный кислород при С-4 замещается аминогруппой. У млекопитающих донор аминогруппы-боковая цепь глутамина, а у Е.. coli в этой реакции участвует NH4+. В обеих реакциях аминирования расходуется молекула АТР.
22.13. Биосинтез пиримидиннуклеотидов регулируется ингибированием по принципу обратной связи
Решающий этап в биосинтезе пиримидиннуклеотидов Е. соli- образование N-карба- моиласпартата из аспартата и карбамоил-фосфата. Фермент, катализирующий эту реакцию, аспартат-транскарбамоилаза, ингибируется конечным продуктом биосинтетического пути-СТР. Еще один регуляторный элемент - карбамоилфосфат-синта- за; она ингибируется другим продуктом биосинтеза-UMР.
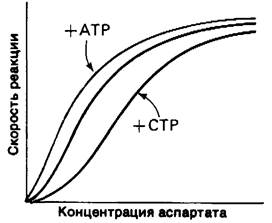
Аллостерические свойства АТКазы детально исследовали Джон Герарт и Ховард Шахман (John Gerhart, Howard Schachman). Связывание карбамоилфосфата и аспартата кооперативно; это выражается в сигмоидной форме графика зависимости скорости реакции от концентрации субстрата (рис. 22.14). СТР ингибирует фермент, снижая его сродство к субстратам и не влияя при этом на Vmax. Степень ингибирующего эффекта СТР может достигать 90% и зависит от концентрации субстратов. АТР, напротив, активирует АТКазу. Сродство этого фермента к субстратам увеличивается под действием АТР, тогда как на Vmax АТР не оказывает влияния. Кроме того, связывание АТР и СТР с регуляторным участком АТКазы носит конкурентный характер. АТР в высокой концентрации вытесняет СТР из комплекса с ферментом, и последний не может оказывать ингибиторного действия.
Рис. 22.14. Аллостерические свойства аспартат - транскарбамоилазы. АТР - активатор, СТР - ингибитор фермента
Активация АТКазы под действием АТР имеет двоякий биологический смысл, Во- первых, она уравнивает скорости образования пурин- и пиримидин нуклеотидов. Для синтеза нуклеиновых кислот необходимы сравнимые количества этих двух типов нуклеотидов. Во-вторых, активация под действием АТР сигнализирует о его достаточной концентрации в качестве субстрата для некоторых реакций биосинтеза пиримидиннуклеотидов, например, для синтеза карбамоилфосфата и фосфорилирования UMP до UTP.
22.14. Аспартат-транскарбамоилаза состоит из отдельных каталитической и регуляторной субъединиц
Если обработать АТКазу каким-нибудь органическим соединением ртути, например, n-гидроксимеркурийбензоатом, она теряет свои регуляторные свойства. АТР и СТР уже не влияют на ее каталитическую активность. Кроме того, связывание субстратов становится некооперативным. Тем не менее модифицированный фермент обладает полноценной каталитической активностью. Такая утрата регуляторных свойств при сохранении ферментативной активности называется десенсибилизацией.
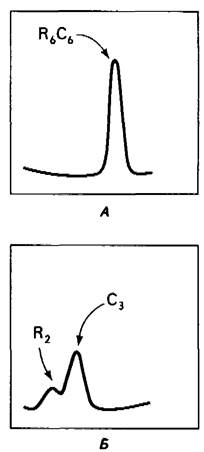
Десенсибилизация АТКазы органическими соединениями ртути сопровождается ее диссоциацией на субъединицы двух типов, как показали исследования с применением ультрацентрифугирования (рис. 22.15). Коэффициент седиментации нативного фермента 11,6S, а коэффициент седиментации диссоциированных субъединиц - 2,8 и 5,8 S. Эти субъединицы можно легко разделить с помощью ионообменной хроматографии, так как они существенно различаются по заряду, или с помощью ультрацентрифугирования в градиенте концентрации сахарозы, так как они различаются по размеру. После того как субъединицы разделены, n-гидроксимеркурийбензоат можно удалить. Большая субъединица каталитически активна; ее называют каталитической субъединицей. Однако АТР и СТР не влияют на активность выделенной каталитической субъединицы. Меньшая субъединица, называемая регуляторной субъединицей, лишена каталитической активности, но содержит специфические участки связывания СТР и АТР. Каталитическая субъединица состоит из трех поли пептидных цепей с мол. массой по 34 кДа, а регуляторная-из двух цепей по 17 кДа.
Рис. 22.15. Картина седиментации в ультрацентрифуге нативной АТКазы (А) и того же фермента, продиссоциировавшего под действием соединения ртути на регуляторную и каталитическую субъединицы (Б)
При смешивании каталитической и регуляторной субъединиц они быстро соединяются. Образуется комплекс с такой же структурой, как и нативный фермент-
R 6С6:
3R2 + 2С3 → R6C6.
Более того, реконструированный фермент обладает такими же аллостерическими свойствами, как и нативный фермент.
В лаборатории Уильяма Липскома (William Lipscomb) проводится кристаллографическое изучение АТКазы с помощью рентгеноструктурного анализа. Карта электронной плотности с разрешением 3,0 А показывает, что два каталитических триме- ра (С3) расположены сверху и снизу от расположенного экваториально пояса, состоящего из трех регуляторных димеров (R2) (рис. 22.16). Особенность этой молекулы состоит в том, что она содержит большую центральную полость, доступ в которую открывается через несколько каналов. Интересно отметить, что аллостерические участки связывания СТР расположены далеко от каталитических центров.
Рис. 22.16. Расположение каталитических (К, синие шарики) и регуляторных (Р, розовые шарики) субъединиц аспартат-тран- скарбамоилазы
