БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 22. БИОСИНТЕЗ НУКЛЕОТИДОВ
22.15. Дезоксирибонуклеотилы синтезируются путем восстановления рибонуклеозиддифосфатов
Перейдем теперь к синтезу дсзоксирибонуклеотидов. Эти предшественники ДНК образуются путем восстановления рибонуклеотидов. 2-гидроксильная группа остатка рибозы замещается атомом водорода.
В клетках E.coli и млекопитающих субстратами этой реакции служат рибонуклеозиддифосфаты. Общая стехиометрия этой реакции следующая:
Рибонуклеозиддифосфаг + NADPH + Н → Дезоксирибонуклеозиддифосфат + NADP++ Н2О.
В действительности механизм реакции гораздо сложнее, чем можно судить по этому уравнению. Питер Рейхард (Peter Reichard) показал, что у Е.соli электроны переносятся на субстрат через ряд сульфгидрильных групп. Заключительную реакцию катализирует рибонуклеотид-редуктаза (ее также называют рибонуклеозиддифосфат-редуктазой). Стехиометрия этой реакции описывается следующим уравнением:
Рис. 22.17. Электронная микрофотография аспартат-транскарбамоилазы
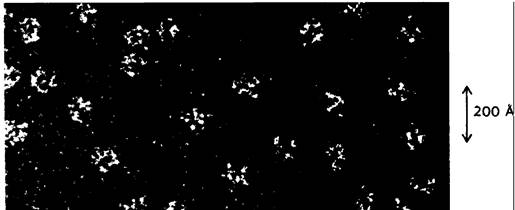
Этот фермент состоит из двух субъединиц: В1 (димер с мол. массой 160 кДа) и В2 (димер с мол. массой 78 кДа). В субъединице В1 имеются участки связывания рибонуклеотидных субстратов и аллостерических эффекторов. Кроме того, В1 содержит сульфгидрильные группы, которые служат непосредственными донорами электронов при восстановлении рибозного остатка. В2-белок, содержащий железо и серу; он участвует в катализе, образуя необычный свободный радикал ароматического кольца тирозинового остатка. Субъединицы В1 и В2 вместе участвуют в формировании активных центров фермента (рис. 22.18).
Рис. 22.18. Модель рибонуклеотид-редуктазы Е. coli
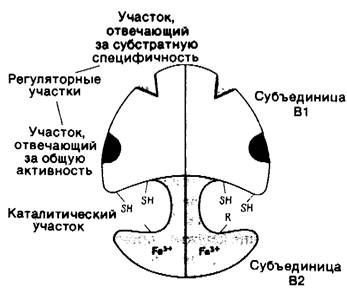
Каким образом электроны переносятся с NАDРН на сульфгидрильные группы в каталитическом центре рибонуклеотид-редуктазы? Один из переносчиков восстановительного потенциала - тиоредоксин, белок с мол. массой 12000 Да, содержащий два цистеиновых остатка в непосредственной близости друг от друга (рис. 22.19). Эти сульфгидрильные группы окисляются, образуя дисульфид в результате реакции, катализируемойрибонуклеотид- редуктазой. Восстановленный тиоредоксин в свою очередь регенерируется ь ходе реакции NADPH с окисленным тиоредоксином.
Рис. 22.19. Схематическое изображение конформации основной цепи окисленного тиоредоксина Е. coli. Желтым цветом показана реакционноспособная дисульфидная связь, участвующая в реакции
Эта реакция катализируется флавопротеином тиоредоксин-редуктазой. Раньше считалось, что тиоредоксин - единственный переносчик восстановительной способности на рибонуклеотид-редуктазу. Однако было обнаружено, что мутант Е.соli, полностью лишенный тиоредоксина, синтезирует дезоксирибонуклеотиды. Это неожиданное открытие привело к выделению второй системы переносчиков. Оказалось, что донор электронов у этого мутанта-цистеинсодержащий трипептид глутатион. Как говорилось выше (разд. 15.12), глутатион-редуктаза катализирует восстановление окисленного глутатиона (дисульфидной формы) за счет NADPH. Кроме того, для переноса восстановительной способности глутатиона на рибонуклеотид-редуктазу нужен еще один белок глутаредоксин (рис. 22.20). Соотношение активностей тиоредоксиновой и глутаредоксиновой систем в восстановлении рибонуклеотидов в нормальных клетках пока неизвестно.
Рис. 22.20. Рибонуклеозиддифосфаты восстанавливаются до дезоксири- бонуклеозиддифосфатов под действием рибонуклеотид-редуктазы. Электроны переносятся с молекулы NАDРН через ряд сульфгидрильных групп. Источниками восстановительной способности могут служить тиоредоксиновая система (обозначено желтым цветом) и глутаредоксиновая система (обозначено зеленым цветом)

Восстановление рибонуклеотиддифосфатов тонко регулируется аллостерическими взаимодействиями. Субъединица В1 рибонуклеотид-редуктазы содержит два типа аллостерических участков: один из них регулирует общую активность фермента, другой - субстратную специфичность. Общая каталитическая активность рибону- клеотид-редуктазы снижается при связывании dATP, который сигнализирует об изобилии дезоксирибонуклеотидов. Это ингибирование по механизму обратной связи обращается при связывании АТР. Связывание dATPили АТР с участками, регулирующими субстратную специфичность, увеличивает восстановление пиримидиннуклеотидов UDP и CDP. Восстановление G DP стимулируется связыванием dTTP, который также ингибирует восстановление пиримидиннуклеотидов. Последующее увеличение концентрации dGTP приводит к стимуляции восстановления ADP. Очевидно, рибонуклеотид-редуктаза имеет множество конформационных состояний с различными каталитическими свойствами. Эта сложная схема регуляции обеспечивает синтез достаточного количества четырех дезоксирибонуклеотидов для синтеза ДНК.
22.16. Дезокситимнднлат образуется путем метилирования дезоксиуридилата
Урацил не входит в состав ДНК. Вместо него ДНК содержит тимин, метилированный аналог урацила. Последний штрих вносится в структуру этого предшественника на уровне дезоксирибонуклеозидмоно- фосфата: дезоксиуридилат (dUMP) метилируется с образованием дезокситимидила- та (dTMP) под действием тимидилат-синтетазы. Донором метильных групп в этой реакции служит производное тетра- гидрофолята, а не S-аденозилметиозин. Метальный углерод происходит из N5, N10-металентетрагидрофолята. Обратите внимание, что метальная группа, которая вводится в дезоксиуридилат, находится в более восстановленном состоянии, чем метиленовая группа в этом производном тетрагидрофолята. Откуда же берутся электроны для этой реакции восстановления? Два электрона переходят из самого остатка тетрагидрофолята в виде гидрид- иона (Н-), который отщепляется от кольца. Этот водород входит в метильную группу dTMP. Тетрагидрофолят в этой реакции окисляется до дигидрофолята. Таким образом, N5, N10-метилентетрагид- рофолят служит и донором электронов, и донором одноуглеродного фрагмента в реакции метилирования (рис. 22.21).
Рис. 22.21. Синтез dTMP из dUMP
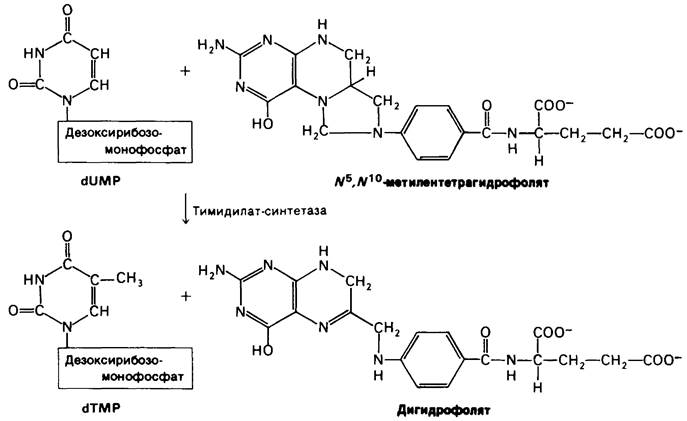
Напомним, что перенос одноуглеродного фрагмента происходит на уровне тетрагидрофолята, а не дигидрофолята. Следовательно, тетрагидрофолят обязательно должен регенерироваться. Это происходит под действием дигидрофолят-редуктазы с использованием в качестве восстановителя NАDРН:
Дигидрофолят + НАDРН + Н+ → Тетрагидрофолят + NADP+.
22.17. Некоторые противораковые препараты блокируют синтез дезокситимидилата
Быстро делящиеся клетки нуждаются в большом количестве дезокситимндилата для синтеза ДНК. Чувствительность этих клеток к ингибированию синтеза dTMP используется в химиотерапии рака (рис. 22.22). Обычно в качестве мишеней избирают ферменты тимидилат-синтетазу и дигидрофолят-синтетазу. Фторурацил (или фтордезоксиуридин)-широко используемый в клинической практике противораковый препарат. Он превращается in vivo во фтордезоксиуридилат (F-dUMP). Этот аналог dUMP необратимо ингибирует тимидилат-синтетазу после того, как он проходит в качестве нормального субстрата часть каталитического цикла. Прежде всего сульфгидрильная группа фермента присоединяется к С-6 связанного F-dUMP. Затем метилентетрагидрофолят присоединяется к С-5 этого промежуточного продукта. Если в реакции участвует dUMR, то на следующем этапе гидрид-ион перемещается на метиленовую группу метиленте- трагидрофолята, и от С-5 связанного нуклеотида отнимается протон. Но если в реакцию вступает F-dUMP, фермент не может отнять F+и катализ блокируется на стадии образования ковалентного комплекса между F-dUMP, метилентетрагидрофолятом и сульфгидрильной группой фермента.
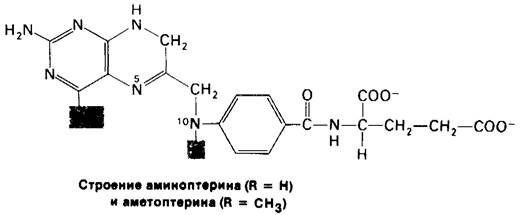
Рис. 22.22. Тимидилат-синтетаза и диги- дрофолят-редуктаза - мишени действия различных препаратов при химиотерапии рака. Фтордезоксиуридилат ингибирует метилирование dUМР. Аналоги фолиевой кислоты аминоптерин и аметоптерин (метотрексат) блокируют регенерирование тетрагидрофолята

Синтез dTMP можно блокировать так же, подавив регенерирование тетрагидрофолята (рис. 22.22). Аналоги тетрагидрофолята, например, аминоптерип и аметоптерип (метотрексат), мощные конкурентные ингибиторы дигидрофолят-редуктазы (Кi-<10-9 М) (рис. 22.24). Аметоптерин - важное лекарственное средство при лечении острой лейкемии и хориокарциномы.
Рис. 22.24. Трехмерная структура дигидрофолят-редуктазы Е. coli со связанной молекулой аметоптерина (метотрексата)
