БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 13. ЦИКЛ ТРИКАБОНОВЫХ КИСЛОТ
13.11. Вариации на мультиферментную тему: альфа-оксоглутарат-дегидрогеназный комплекс
Окислительное декабоксилирование α-оксоглутарата имеет много общего с соответствующим процессом для пирувата:
α-Оксоглутарат + СоА + NAD+ → Сукцинил-СоА + СO2 + NADH,
Пируват + СоА + NAD+ → Ацетил-СоА + СO2 + NADH.
В обеих реакциях участвуют одни и те же кофакторы: ТПФ, липоамид, СоА, FAD и NAD+. Посуществу окислительное декар- боксилирование а-оксоглутарата катализируется ферментным комплексом, сходным по структуре с пируват-дегидрогеназным комплексом. В состав α-оксоглутарат-дегидрогеназного комплекса входят три вида ферментов: α-оксоглутарат-дегидрогеназ- ный (А'), транссукцинилазный (В') и диги- дролипоил-дегидрогеназный (С') компоненты. Далее, А' связывается с В' и В' связывается с С', но А' с С непосредственно не связывается. Таким образом, ядро комплекса составляет транссукцинилаза (аналогично трансацетилазе).
α-Оксоглутарат — дегидрогеназный компонент (А') и транссукцинилаза (В') отличаются от соответствующих ферментов (А и В) пируват-дегидрогеназного комплекса. В то же время дигидролипоил-дегидроге- назные части (С и С') обоих комплексов идентичны. Опыты с реконструированием этих систем показали, что комплекс, образованный А, В и С', также активен в отношении окислительного декарбоксилирова- ния пирувата, как комплекс из А, В и С. Подобно этому, С и С' взаимозаменяемы при образовании реконструированного комплекса, осуществляющего окислительное декарбоксилирование α -оксоглутарата.
Как ранее было отмечено, химотрипсин, трипсин, тромбин и эластаза являются гомологичными ферментами. Здесь мы видим, что пируват- и α -оксоглутарат — — дегидрогеназные комплексы представляют собою гомологичные ассоциации ферментов. Структурные и механистические особенности, обеспечивающие координированный катализ на входе в цикл трикарбоновых кислот, вновь используются позднее в процессе функционирования этого цикла.
13.12. Бери-бери вызывается недостаточностью тиамина
«Одно очень мучительное заболевание, которое поражает человека, названо местными жителями бери-бери (что означает «овца»). Я видел тех, кого поразила эта болезнь. У них дрожат колени, они высоко поднимают ноги и ходят подобно овцам. Это вид паралича или скорее тремора. У больных наблюдаются отклонения в характере движений, нарушается чувствительность рук и ног, а иногда и всего тела...» Так описал бери-бери датский врач Якобус Бонитус (Jacobus Bonitus) в 1630 г., когда он работал на острове Ява.
Бери-бери вызывается недостатком в пище тиамина (называемого также витамином В,). Болезнь была и остается серьезной проблемой для жителей Дальнего Востока, поскольку рис, их основной продукт питания, беден тиамином. Проблема еще обостряется использованием в пищу полированного риса, потому что только наружный слой рисового зерна содержит заметные количества тиамина. Бери-бери иногда встречается при остром истощении у алкоголиков. Болезнь характеризуется симптомами неврологических заболеваний и сердечной недостаточности. Повреждение периферической нервной системы проявляется в виде болей в конечностях, мышечной слабости, нарушения кожной чувствительности. Сердце может быть увеличено, а минутный объем пониженным.
Каким же образом недостаточность тиамина вызывает эти симптомы? Тиаминпирофосфат служит простетической группой трех важных ферментов: пируват-дегидрогеназы, а-оксоглутарат—дегидрогеназы и транскетолазы. Транскетолаза переносит двухуглеродные компоненты с одного сахара на другой; ее роль в пентозофосфатном пути будет рассматриваться позднее. Общей особенностью ферментативных реакций, протекающих с использованием ТПФ, является перенос активированного альдегидного фрагмента. При бери-бери содержание пирувата и α-оксоглутарата в крови превышает норму. Увеличение содержания пирувата особенно выражено после приема глюкозы. В соответствии с этим ферментативные активности пируват- и α-оксоглутарат-дегидрогеназных комплексов in vivo снижены по сравнению с нормой. Кроме того, при бери-бери снижена транскетолазная активность эритроцитов. Определение активности этого фермента может применяться для диагностики данного заболевания.
13.13. Симметричные молекулы могут реагировать асимметрично
Проследим судьбу определенного углеродного атома в цикле трикарбоновых кислот. Предположим, что в оксалоацетате изотопом 14С помечен карбоксильный углерод, наиболее удаленный от оксогруппы. Анализ образовавшегося α -оксоглутарата покажет, что потери радиоактивной метки не происходит. Декарбоксилирование а-оксоглутарата приведет тогда к образованию сукцината, лишенного радиоактивности, а вся метка будет содержаться в высвободившемся СO2. Тот факт, что вся метка обнаруживается в составе СO2, явился полной неожиданностью. Цитрат-молекула симметричная. Поэтому считалось, что две его —СН2СОО - -группы должны реагировать идентично. Значит, предполагалось далее, на каждую молекулу цитрата, превращающуюся по пути 1, должна приходиться другая молекула цитрата, превращающаяся по пути 2. Если это так, то в составе СO2 должна появляться только половина метки.
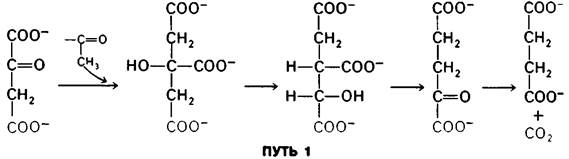
Эти эксперименты, проведенные в 1941 г., были интерпретированы таким образом, что, поскольку превращение метки носит асимметричный характер, цитрат (или какое- либо другое симметричное соединение) не может быть промежуточным продуктом при образовании α-оксоглутарата. Такая интерпретация казалась неоспоримой до 1948 г., когда Александр Огстон (Alexander Ogston) проницательно указал на ошибочность утверждения, что две идентичные группы в симметричной молекуле не могут быть дифференцированы ферментом: «Напротив, возможно, что асимметричный фермент, действующий на симметричное соединение, может различать его идентичные группы... асимметричное распределение изотопа в продукте реакции не может считаться аргументом против его образования из симметричного предшественника».
Проанализируем утверждение Огстона. Для простоты рассмотрим молекулу, в которой два водородных атома, группа X и другая группа Y связаны с тетраэдрическим атомом углерода. Обозначим один водород А, второй-В. Предположим теперь, что фермент связывает три группы этого субстрата: X, Y и Н. Может ли он отдифференцировать НА от Нв? На рис. 13.12 показано связывание X, Y и НA с тремя участками фермента. Отметим, что X, Y и Нв не могут быть связаны с этим активным центром, вернее, могут быть связаны две группы, но не все три. Таким образом, судьба НA и Нв должна быть различной.
Рис. 13.12. НА и Нв стерически неэквивалентны, если субстрат СХYН2 связано с ферментом в трех участках
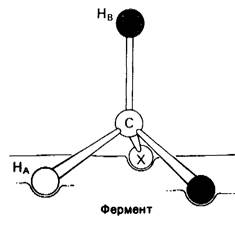
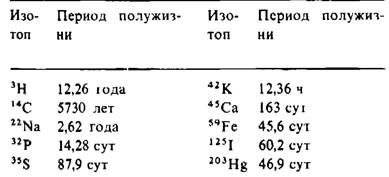
Таблица 13.3. Обычно применяемые радиоактивные изотопы
Следует заметить, что НА и Нв стерически неэквивалентны, несмотря даже на то, что молекула СХУН2 лишена оптической активности. Точно так же стерически неэквивалентны —СН2СОО-группы цитрата, несмотря на отсутствие оптической активности у цитрата. Правила симметрии, которые определяют, имеются ли в соединении неразличимые заместители, отличаются от правил, определяющих, является ли оно оптически неактивным: 1) молекула оптически неактивна, если она может быть наложена на свое зеркальное отражение; 2) молекула имеет неразличимые заместители только в том случае, если эти группы совпадают при вращении, когда остальная структура остается без изменения.
Стерически неэквивалентные группы, такие, как НA и Нв, почти всегда различаются при ферментативных реакциях. Смысл дифференциации этих групп состоит в том, что фермент удерживает субстрат в состоянии специфической ориентации. Присоединение по трем точкам, как показано на рис. 13.12. наглядный, но не единственный путь к достижению особой ориентации субстрата.
Хиральность- «Я называю геометрическую фигуру или группу точек хиральной и говорю, что она обладает хиральностью, если ее идеально реализованное отражение в плоском зеркале не совпадает с ней при наложении».
Кельвин (1893 г.)
Происходит от греч. cheir-рука.
Термины «хиральный» и «прохиральный» теперь широко используются при описании стереохимии молекул. Хиральная молекула обладает асимметрией и, следовательно, является оптически активной. Прохиральная молекула, такая, как цитрат или СХУН2, лишена асимметрии и соответственно оптически неактивна. Однако она может стать хиральной в результате всего лишь одного этапа. Прохиральная молекула (такая, как СХУНАНВ) превращается в хиральную (СХУZНВ) при замещении одного из ее идентичных атомов или одной из групп (в данном примере НА). Приставки R и S используются для определенного обозначения хиральных и прохиральных центров, как описано в приложении к данной главе (стр. 69).