БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 13. ЦИКЛ ТРИКАБОНОВЫХ КИСЛОТ
13.14. Стереоспецифический перенос водорода NAD+ -дегидрогеназами
В 50-х годах Бриджит Веннесланд, Франк Вестхеймер (Brigit Vennesland, Frank Westheimer) и их сотрудники провели изящный эксперимент по стереоспецифичности переноса водорода NАD+ -дегидрогеназами. Субстратом реакции, катализируемой алколь-дегидрогеназой, был этанол, меченный двумя атомами дейтерия, при С-1. Было установлено, что восстановленный кофермент содержит один атом дейтерия на молекулу, тогда как второй атом дейтерия входит в состав ацетальдегида. Таким образом, потери дейтерия и перехода его в растворитель не происходило, и он прямо переносился с субстрата на NAD+.
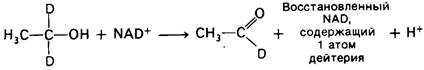
Дейтерированный восстановленный кофермент, образующийся в этой реакции, использовали затем для восстановления ацетальдегида. Результат оказался поразительным: дейтерий целиком переносился с кофермента на субстрат и совсем не обнаруживался в составе NAD+.
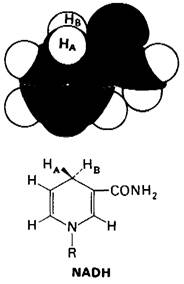
Эти реакции доказывают стереоспецифичность переноса, катализируемого алкоголь- дегидрогеназой. Положения, занимаемые двумя атомами водорода, при С-4 в NАDН, неравноценны. Один из них (НА) находится впереди, второй (Нв)- позади плоскости расположения никотинамида. Иными словами, С-4 представляет собою прохиральный центр. Алкоголь-дегидрогеназа, хиральный реагент, различает положения А и В при С-4. Дейтерий переносится от дейтерированного этанола только в положение А. При обратной реакции атом дейтерия удаляется из положения А и прямо переносится на ацетальдегид.
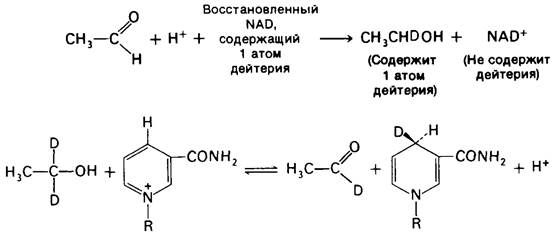
Некоторые дегидрогеназы, такие, например, как глицеральдегидфосфат-дегидрогеназа, переносят водород в положение В. Таким образом, существуют два класса NAD+ (и NADP+)-дегидрогеназ: А-стереоспецифическая и В-стереоспецифическая. Сравнение трехмерных структур NAD+-дегидрогеназ показывает, что различие в стереоспецифичности ферментов А- и В-типов возникает вследствие поворота никотин- амидного кольца на 180° по отношению к соседнему рибозному компоненту. В результате этого сдвига на 180° в А- и В-дегидрогеназах экспонируются и, следовательно, становятся реакционноспособными элементы противоположной стороны никотинамидного кольца. Как и можно было ожидать, все известные дегидрогеназы стереоспецифичны. Когда дегидрогеназа реагирует с рядом субстратов, стереоспецифичность переноса водорода для всех них одинакова. Сохранение NAD+ -связывающих мест в ходе эволюции подчеркивается тем фактом, что стереоспецифичность отдельной дегидрогеназы не зависит от вида организма (так, алкоголь-дегидрогеназы дрожжей и лошади имеют одинаковую стереоспецифичность). Более того, стереоспецифичность определенной реакции, катализируемой ферментами, использующими и NAD+ и NADP+, оказывается одной и той же для обоих коферментов.
Рис. 13.13. Модель и формула никотинамидного компонента NADH, показывающая, что НA и Нв находятся на противоположных сторонах кольца. По RS-номенклатуре НА - про-R, Нв- про-S
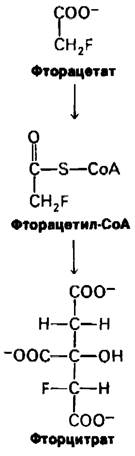
13.15. Летальный синтез: превращение фторацетата во фторцитрат
Цикл трикарбоновых кислот блокируется у животных, поедающих листья Dichapetalum cymosum, ядовитого южноафриканского растения. В течение часа содержание цитрата в большинстве органов возрастает более чем в 10 раз. У отравленных животных начинаются судороги, и они обычно погибают через короткое время. Токсическим агентом этих листьев является фторацетат, который используется также в качестве крысиного яда. Однако фторацетат не действует на очищенные ферменты цикла трикарбоновых кислот. Почему же тогда этот цикл блокируется при потреблении фторацетата in vivo? Объясняется это тем, что в организме фторацетат подвергается ферментативному превращению во фторцитрат, мощный ингибитор аконитазы. Фторацетат активируется во фторацетил-СоА, который затем конденсируется с оксалоацетатом, образуя фторцитрат.
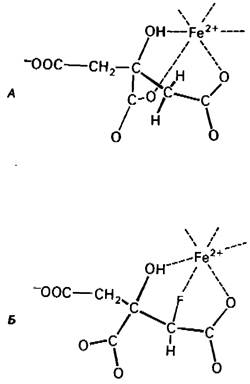
Активный центр аконитазы содержит ион Fе2+, который в норме образует хелаты с атомом кислорода гидроксильной группы и двумя атомами кислорода карбоксильных групп цитрата. Фторцитрат в противоположность этому связывается таким образом, что его атом фтора образует хелат с ионом железа (рис. 13.14). Высокий электроотрицательный заряд фтора способствует его сильному взаимодействию с Fe2+, что приводит к ингибированию фермента. Важно отметить, что превращение фторацетата в фторцитрат - не единственный случай синтеза, приводящего к летальному исходу. Многие химические вещества, сами по себе относительно безобидные, могут под действием ферментов превращаться в очень вредные соединения. Например, некоторые полициклические ароматические углеводороды подвер
гаются in vivo ферментативной модификации в мощные мутагены и канцерогены (разд. 20.21).
Рис. 13.14. Предполагаемая модель связывания цитрата и фторцитрата с активным центром аконитазы: A-связывание цитрата, приводящее к катализу; Б - связывание фторцитрата, приводящее к ингибированию. Атом фтора фторцитрата образует хелат с ионом железа в активном центре
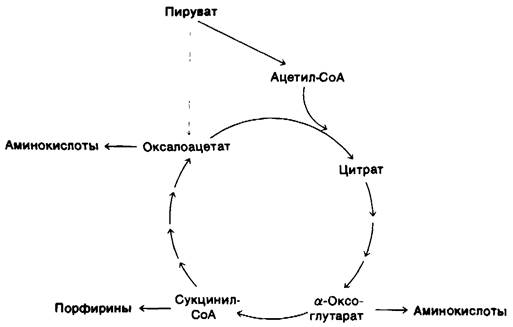
13.16. Цикл трикарбоновых кислот- источник предшественников для процессов биосинтеза
До сих пор, обсуждая цикл трикарбоновых кислот, мы рассматриваем его как основной путь расщепления, обеспечивающий генерирование АТР. Однако цикл трнкарбоновых кислот выполняет и другую роль: он поставляет промежуточные продукты для процессов биосинтеза (рис. 13.15). Например, большинство углеродных атомов в порфиринах происходит из сукцинил-СоА. Многие аминокислоты происходят из α-оксоглутарата и оксалоацетата. Биосинтез этих соединений мы рассмотрим в последующих главах. Здесь же необходимо отметить тот важный момент, что потребление промежуточных продуктов цикла трикарбоновых кислот для целей биосинтеза обязательно должно сопровождаться их пополнением. Предположим, например, что оксалоацетат превращается в аминокислоты, используемые для биосинтеза белка. Если при этом не будет происходить синтеза оксалоацетата de novo, то функционирование цикла трикарбоновых кислот прекратится, поскольку ацетил-СоА может включиться в цикл только после конденсации с оксалоацетатом. Как происходит пополнение оксалоацетата? Млекопитающие лишены ферментативного механизма, обеспечивающего превращение ацетил-СоА в оксалоацетат или другой промежуточный продукт цикла трикарбоновых кислот. Оксалоацетат у них образуется путем карбоксилирования пирувата, катализируемого пируват-карбоксилазой (разд. 15.15).
Пируват + СО2 + АТР + Н2О ⇄ Оксалоацетат + ADP + Рi + 2Н+.
Карбоксилирование пирувата является примером анаплеротической реакции (от греч - «пополнять»).
Рис. 13.15. Роль цикла трикарбоновых кислот в процессах биосинтеза. Промежуточные продукты, выводимые из цикла в результате их использования на нужды биосинтеза (показано красными стрелками), восполняются образоваоием оксалоацетата из пирувата