БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 14. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
14.2. Окислительно-восстановительные потенциалы и изменения свободной энергии
При окислительном фосфорилировании потенциал переноса электронов, присущий NADH или FADH2, преобразуется в потенциал переноса фосфатной группы, присущий АТР. Для этих форм свободной энергии надо найти количественное выражение. Измерение потенциала переноса фосфатной группы нам уже знакомо: оно выводится из ∆G0' для гидролиза фосфатного соединения. Соответствующим выражением для потенциала переноса электронов является окислительно-восстановительный потенциал (называемый также редокс-потенциалом).
Окислительно-восстановительный потенциал - это электрохимическая категория. Рассмотрим для примера вещество, которое может существовать в окисленной X и в восстановленной форме X-. Такая пара называется окислительно-восстановительной парой (рис. 14.3). Окислительно-восстановительный потенциал такой пары можно определить, измеряя электродвижущую силу, развиваемую опытной полукамерой по отношению к стандартной контрольной полукамере. Опытная полукамера представляет собою электрод, погруженный в раствор 1 М окислителя (X) и 1 М восстановителя (X-). Стандартная контрольная полукамера состоит из электрода, погруженного в 1 М раствор Н+, находящийся в равновесии с газообразным Н2 при давлении в 1 атм. Электроды присоединяют к вольтметру и агаровым мостиком обеспечивают электропроводность между полукамерами. Происходит поток электронов от одной полукамеры к другой. Если реакция идет в направлении
X- + Н+ → X + 1/2Н2,
то в полу камерах будут происходить следующие реакции:
X → X + e-,
X + е- → 1/2Н2.
Рис. 14.3. Устройство для измерения стандартного окислительновосстановительного потенциала окислительно-восстановительной пары
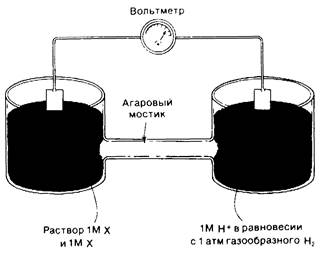
Таким образом, электроны движутся от опытной полукамеры к контрольной и, следовательно, электрод в опытной полукамере заряжен отрицательно по отношению к электроду стандартной полукамеры. Окислителъно-восстановителъный потенциал пары X : Х- соответствует напряжению в начале эксперимента (когда концентрации X, X- и Н+ равны 1 М). Окислительно-восстановительный потенциал пары H+ : Н2 определен равным 0 В (вольт).
Значение окислительно-восстановительного потенциала теперь очевидно. Отрицательный окислительно-восстановительный потенциал говорит о том, что данное вещество имеет меньшее сродство к электронам, чем Н2 (как в вышеприведенном примере). Положительный окислительно-восстановительный потенциал свидетельствует о более высоком, чем у Н2, сродстве данного вещества к электронам. Эти соотношения относятся к стандартным условиям, когда концентрации окислителя, восстановителя и Н+ равны 1 М и давление Н2составляет 1 атм. Таким образом, сильный восстановитель (например, NADН) обладает отрицательным окислительно-воccnановительным потенциалом, тогда как сильный окислитель (O2) имеет положительный окислительновосстановительный потенциал.
Таблица 14.1. Стандартные окислительно-восстановительные потенциалы некоторых реакций

Окислительно-восстановительные потенциалы многих биологически важных окислительно-восстановительных пар известны (табл. 14.1). Изменение свободной энергии окислительно-восстановительной реакции можно легко вычислить из разности окислительно-восстановительных потенциалов реагирующих соединений. Рассмотрим, например, восстановление пирувата за счет NADH:
а) Пируват + NADH + Н+⇄ Лактат + NAD+.
Окислительно-восстановительный потенциал для пары NAD+ : NADH равен — 0,32 В, для пары пируват : лактат — 0,19 В. Условимся окислительно-восстановительные потенциалы, относящиеся к частичным реакциям, записывать следующим образом:
Окислитель + е- → Восстановитель. Тогда
б) Пируват + 2Н+ + 2е- → Лактат
Eо= - 0, 19 В,
в) NAD + Н+ + 2е- → NADH
Eо = - 0, 32 В.
Вычитая реакцию в) из реакции б), получаем желаемую реакцию а) и ∆ Е'0 = + 0,13 В. Теперь можем рассчитать ∆G0' для восстановления пирувата за счет NADH. Изменение стандартной свободной энергии ∆G0' связано с изменением окислительновосстановительного потенциала ∆Е'0 уравнением
∆G0' = -nF ∆Eо,
где n-число переносимых электронов, F- число Фарадея (23,062 ккал • В-1 моль-1), ∆Е'0 выражается в вольтах, ∆G0'-в килокалориях на моль. Для восстановления
пирувата n = 2, и тогда
∆С0' = - 2 • 23,062 • 0,13 = - 6 ккал/моль.
Заметим, что положительное значение ∆Еo указывает на экзергонический характер реакции, протекающей в стандартных условиях.
14.3. Величина окислительновосстановительного потенциала дыхательной цепи составляет 1,14 В, что соответствует 53 ккал
Движущая сила окислительно фосфорилирования-это потенциал переноса электронов, присущий NADH или FАDН2. Рассчитаем ∆Eo и ∆С0', связанные с окислением NADH под действием O2. Промежуточные частичные реакции следующие:
а) 1/2O2 + 2Н+ + 2е- ⇄ Н2O
Eo = + 0,82 В,
б) NAD+ + Н+ + 2е-⇄ NADH
Еo= - 0,32 В.
Вычитая реакцию б) из реакции а), получаем
в) 1/2O2 + NADH + Н+⇄ Н2O + NAD+
∆Е0 = + 1,14 В.
Свободная энергия окисления для этой реакции составляет
∆G0, = nF∆Eo = - 2 • 23,062 • 1,14 = - 52,6 ккал/моль.