БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 17. ОБМЕН ЖИРНЫХ КИСЛОТ
17.17. Промежуточные продукты синтеза жирных кислот присоединены к ацилпереносящему белку
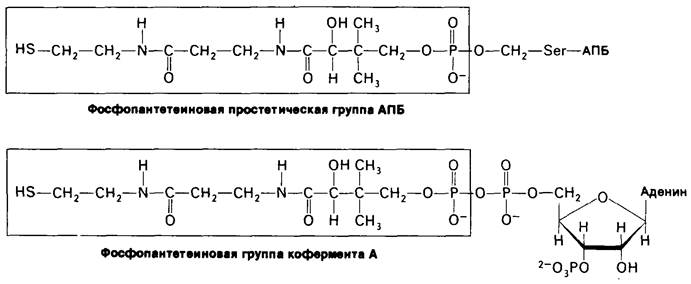
П. Рой Вагелос (Р. Roy Vagelos) обнаружил, что промежуточные продукты синтеза жирных кислот связаны с ацилпереносящим белком (АПБ), а именно с сульфгидрильным концом фосфопантетеиновой группы (рис. 17.11). При расщеплении жирных кислот этот компонент является частью СоА, тогда как при их синтезе он связан с остатком серина в АПБ. Эту одиночную полипептидную цепь из 77 остатков можно рассматривать как гигантскую простетическую группу, «макро-СоА».
Рис. 17.11. Фосфопантетеин - реакционноспособный фрагмент АБП и СоА
17.18. Цикл элонгации в синтезе жирных кислот
Ферментная система, катализирующая синтез насыщенных длинноцепочечных жирных кислот из ацетил-СоА, малонил-СоА и NADPH, называется синтетазой жирных кислот. У высших организмов она присутствует в виде мультиферментного комплекса. В отличие от этого у бактерий ферментные компоненты синтетаз жирных кислот бывают диссоциированы при разрушении клеток. Доступность этих изолированных ферментов облегчила изучение стадий синтеза жирных кислот (табл. 17.3). На самом деле реакции, обеспечивающие синтез жирных кислот у высших организмов, очень сходны с таковыми у бактерий.
Таблица 17.3. Основные реакции в синтезе жирных кислот

Фаза элонгации в синтезе жирных кислот начинается с образования ацетил-АПБ и малонил-АПБ. Эти реакции катализируются ацетил-трансацилазой и малонил- трансацилазой.
Ацетил-СоА + АПБ ⇄ Ацетил-АПБ + СоА,
Малонил-СоА + АПБ ⇄ Малонил-АПБ + СоА.
Малонил-трансацилаза высокоспецифична, тогда как ацетил-трансацилаза может переносить и ацильные группы, отличные от ацетильного компонента, хотя и со значительно меньшей скоростью. Жирные кислоты с нечетным числом углеродных атомов синтезируются, начиная с пропионил- АПБ, который в свою очередь образуется из пропионил-СоА под действием ацетил- трансацетилазы.
Ацетил-АПБ и малонил-АПБ взаимодействуют с образованием ацетоацетил-АПБ. Эта реакция конденсации катализируется ацил-малонил-АПБ-конденсирующим ферментом.
Ацетил-АПБ + Малонил-АПБ → Ацетоацетил-АПБ + АПБ + СO2.
В приведенной реакции конденсации происходит образование четырехуглеродного компонента из двухуглеродного и трехуглеродного компонентов и высвобождается СO2. Почему четырехуглеродный компонент образуется не из двух двухуглеродных фрагментов? Иными словами, почему в качестве реагентов выступают ацетил-АПБ
и малонил-АПБ, а не две молекулы ацетил- АПБ? Ответ заключается в том, что равновесие реакции чрезвычайно неблагоприятно для синтеза ацетоацетил-АПБ из двух молекул ацетил-АПБ. Напротив, равновесие реакции благоприятно для участия в этом синтезе малонил-АПБ, поскольку декарбоксилирование последнего приводит к существенному снижению свободной энергии. В действительности, реакция конденсации запускается АТР, хотя АТР и не принимает в ней прямого участия, а используется для образования богатого энергией субстрата при карбоксилировании ацетил-СоА в малонил-СоА. Свободная энергия, запасенная в малонил- СоА в результате реакции карбоксилирова- ния, высвобождается при декарбоксилировании, сопровождающем образование ацетоацетил-АПБ. Хотя НСО3- требуется для синтеза жирных кислот, его углеродный атом не появляется в образующемся продукте. Все углеродные атомы жирных кислот, содержащих четное их количество, происходят из ацетил-СоА.
Следующие три стадии синтеза жирных кислот состоят в восстановлении оксо- группы при С-3 в метиленовую группу (рис. 17.12). Сначала ацетоацетил-АПБ восстанавливается в D-3-гидроксибутирил- АПБ. Эта реакция отличается от соответствующей реакции при расщеплении жирных кислот двумя особенностями: 1) образуется преимущественно D-, а не L- эпимер и 2) восстанавливающим агентом служит NADPH, тогда как в качестве окисляющего агента при β-окислении используется NAD+. Это различие иллюстрирует общий принцип, согласно которому в реакциях биосинтеза расходуется NADPH, тогда как в результате энергодающих реакций происходит генерирование NADH. Далее D-3-гидроксибутирил-АПБ дегидратируется с образованием кротонил-АПБ, представляющего собою транс-∆2-еноил-АПБ. Конечным этапом цикла является восстановление кротонил-АПБ в бутирил-АПБ. NADPH вновь играет роль восстановителя, тогда как в соответствующей реакции β-окисления окислителем служит FAD+. В результате последних трех реакций-восстановления, дегидратирования и второго восстановления -происходит превращение ацетоацетил- АПБ в бутирил-АПБ, которое завершает первый цикл элонгации.
Рис. 17.12. Последовательность реакций в синтезе жирных кислот: конденсация, восстановление, дегидратация и восстановление. Указанные здесь промежуточные продукты образуются в первом цикле синтеза
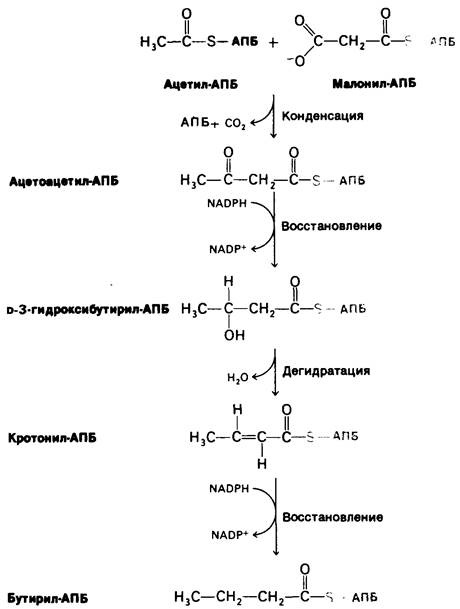
Во втором цикле синтеза жирных кислот бутирил-АПБ конденсируется с малонил-АПБ, давая С6-β-оксоацил-АПБ. Эта реакция подобна конденсации ацетил-АЛБ с малонил-АПБ в первом цикле, приводящей к образованию С4-β-оксоацилАПБ. В результате восстановления, дегидратации и второго восстановления С6-β-оксоацил-АПБ превращается в С6-ацил-АПБ, который может вступать в третий цикл элонгации. Описанные циклы элонгации продолжаются вплоть до образования С16-ацил-АПБ. Этот промежуточный продукт не может служить субстратом для конденсирующего фермента и гидролизуется с образованием пальмитата и АПБ.
17.19. Стехиометрия синтеза жирных кислот
Приводим стехиометрию синтеза пальмитата :
Ацетил-СоА + 7 Малонил-СоА + NADРН + 7Н+ → Пальмитат + 7СO2 + 14NADР + 8СоА + 6Н2O.
При этом использовано следующее уравнение для синтеза малонил-СоА:
7 Ацетил-СоА + 7СО2 + 7АТР → 7 Малонил-СоА + 7АDР + 7 Рi + 7Н+.
Отсюда выводим итоговую стехиометрию синтеза пальмитата:
8 Ацетил-СоА + 7АТР + 14NADPH → Пальмитат + 14NADP++ 8СoА + 6Н2O + 7ADP + 7Рi.