БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 21. БИОСИНТЕЗ АМИНОКИСЛОТ И ГЕМА
В этой главе рассматривается биосинтез аминокислот и некоторых молекул, которые из них образуются. Прежде всего мы рассмотрим реакции, приводящие к включению азота в состав аминокислот. Этот путь начинается с восстановления N2 до NН4 в клетках азотфиксирующих микроорганизмов. Затем NH4 включается в аминокислоты через глутамат и глутамин, два ключевых соединения азотистого метаболизма. Десять из основного набора двадцати аминокислот синтезируются из промежуточных продуктов цикла трикарбоновых кислот и других метаболических последовательностей с помощью несложных реакций. Мы рассмотрим эти биосинтетические пути и опишем биосинтез ароматических аминокислот и гистидина в качестве примеров аминокислот, синтезирующихся более сложным образом. На самом деле человек должен получать эти десять аминокислот с пищей, потому их и называют незаменимыми аминокислотами. В этих реакциях участвуют два весьма любопытных посредника: тетрагидрофолят, многоцелевой переносчик одноуглеродных единиц трех степеней окисления, и S-аденозилметионин, главный донор метальных групп. Еще одна важная сфера наших интересов-регуляция метаболизма аминокислот. На примере глутамин-синтетазы мы проиллюстрируем некоторые общие принципы регуляции. Конец настоящей главы посвящен синтезу и распаду гема.
21.1. Микроорганизмы используют АТР и сильный восстановитель для превращения N2в NH4
Атомы азота аминокислот, пуринов, пиримидинов и других биологических молекул происходят из NH4+. Высшие организмы неспособны включать N2в органические соединения. Это превращение -азотфиксация - осуществляется только бактериями и сине-зелеными водорослями (цианобактериями). Некоторые из этих микроорганизмов, а именно бактерии Rhizobium, заражают корни бобовых растений и образуют корневые клубеньки, в которых и происходит азотфиксация (рис. 21.2). Взаимоотношения между бактериями и растением носят характер симбиоза. Считается, что микроорганизмы переводят в органическую форму примерно 2 • 1011 кг N2в год.
Рис. 21.1 Электронная микрофотография глутамин-синтетазы Е. coli. Этот фермент играет ключевую роль в метаболизме азота

Рис. 21.2. Клубеньки на корневой системе сои-место, где происходит азотфиксация бактериями Rhizobium
Энергия связи N=N составляет 225 ккал/моль. Эта связь весьма устойчива к химическим воздействиям. Ведь Лавуазье назвал этот элемент из-за его инертности «азот», что означает «безжизненный». Промышленный процесс азотфиксации был разработан Фрицем Габером (Fritz Haber) в 1910 г. и используется в настоящее время при производстве удобрений:
N2+ ЗН2⇄ 2NH3.
Эту реакцию обычно проводят в присутствии железа в качестве катализатора при температуре около 500° С и давлении 300 атм. Неудивительно поэтому, что биологический процесс азотфиксации осуществляется сложным ферментом. Нитрогеназный комплекс, катализирующий эту реакцию, состоит из белковых компонентов двух типов: редуктазы, которая поставляет электроны с высокой восстановительной способностью, и собственно нитрогеназы, которая использует эти электроны для восстановления N2до NH4+(рис. 21.3). Оба компонента представляют собой железосеропротеины (Fe-S-белки), в которых железо связано с атомом серы остатка цистеина и с неорганическим сульфидом (разд. 14.4), Нитрогеназный компонент комплекса содержит, кроме того, один или два атома молибдена, поэтому раньше его называли Мо- Fe-белком. Его субъединичная структура α2β2, а мол. масса — 200 кДа. Редуктазный компонент - (называемый также Fe-белком) состоит из двух идентичных полипептидов. Его мол. масса — 65 кДа. В нитрогеназном комплексе один или два Fe-белков связаны с Mo-Fe-белком.
Рис. 21.3. Схематическое изображение нитрогеназного комплекса. Перед тем как N2 превращается в NН4, комплекс диссоциирует и редуктаза отделяется от нитрогеназного компонента
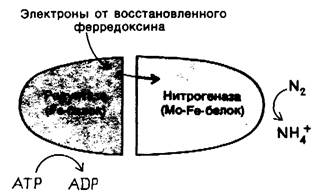
Для превращения N2 в NH4+ под действием нитрогеназного комплекса необходимы АТР и мощный восстановитель. У большинства азотфиксирующих микроорганизмов источником электронов с высоким потенциалом для этой шестиэлектронной реакции служит восстановленный ферредоксин, переносчик электронов, который мы уже рассматривали при обсуждении фотосинтеза (разд. 19.9). Регенерирует ли затем восстановленный ферредоксин путем фотосинтеза или в результате
окислительных процессов, зависит от организма. Реакции, катализируемые нитроге- назным комплексом, имеют следующую стехиометрию;
N2 + 6е- + 12АТР +12Н2O → 2NH4+ +12ADP + 12Pi + 4Н+.
Проведенные недавно исследования нитро- геназы свидетельствуют о следующей последовательности реакций. Сначала восстановленный ферредоксин отдает электроны редуктазному компоненту комплекса. На втором этапе АТР связывается с редуктазой и сдвигает ее окислительно-восстановительный потенциал с - 0,29 до - 0,40В путем изменения ее конформации. Это увеличение восстановительной способности редуктазы позволяет ей переносить электроны на нитрогеназный компонент. На третьей стадии происходит перенос электронов, гидролизуется АТР и редуктаза отделяется от нитрогеназного компонента. Наконец, N2 связывается с нитрогеназным компонентом комплекса и восстанавливается до NH4. Поскольку источники энергии для химического производства аммиака по методу Габера истощаются и становятся все дороже, специалисты проявляют всевозрастающий интерес к увеличению азотфиксации микроорганизмами. Один из возможных подходов состоит в том, чтобы гены, необходимые для азотфиксации, ввести в растения, не относящиеся к бобовым, например, в злаки. Трудность, которую предстоит преодолеть, состоит в исключительной чувствительности нитрогеназного комплекса к инактивации в присутствии кислорода. Бобовые растения поддерживают чрезвычайно низкую концентрацию О2 в корневых клубеньках путем связывания О2 с леггемоглобином. Еще одна проблема на пути создания новых азотфиксирующих видов-необходимость необычайно быстрого образования АТР. Ведь азотфиксирующие бактерии в корнях бобовых растений потребляют примерно пятую часть всего АТР, который образуется в растении. Существует и другой подход-увеличение скорости азотфиксации в клетках сине-зеленых водорослей, которые образуют собственный АТР путем фотосинтеза и поэтому не зависят от энергетических реакций симбиотического партнера.
21.2. NH+4 включается в аминокислоты через глутамат и глутамин
Следующий этап введения азота в биологические молекулы-включение NH4+ в аминокислоты. Глутамат и глутамин играют в этом процессе ключевую роль, α-Амино- группа большинства аминокислот переносится от α-аминогруппы глутамата в результате реакции трансаминирования. Еще один важный донор азота, глутамин, отдает азот своей боковой цепи при биосинтезе ряда важных соединений.
Глутамат синтезируется из NH4+ и α-оксо- глутарата, промежуточного продукта цикла трикарбоновых кислот, под действием глутамат-дегидрогеназы. Мы уже встречались с этим ферментом в разделе, посвященном распаду аминокислот (разд. 18.1). Когда реакция идет в направлении биосинтеза, используется NADPH в качестве восстановителя; когда же реакция является катаболической, в ней участвует NAD+ в качестве окислителя;
NH4+ + α-Оксоглутарат + NADPH + Н+⇄ L-Глутамат + NADP+ + H2O.
Ион аммония вводится в глутамин под действием глутамин-синтетазы. Эта реакция амидирования сопряжена с гидролизом АТР. Регуляция глутамин-синтетазы играет важнейшую роль в регуляции всего азотистого обмена. Мы обсудим этот вопрос несколько позже.
Глутамат-дегидрогеназа и глутамин-синтетаза присутствуют во всех организмах. У большинства прокариот имеется, кроме того, глутамат-синтаза, катализирующая восстановительное аминирование α-оксо- глутарата. Донор азота в этой реакции — глутамин; в результате реакции образуются две молекулы глутамата;
α-Оксоглутарат + Глутамин + NADPH + Н+ → 2 Глутамат + NADP+.
Если фактором, ограничивающим скорость реакции, является содержание в клетке NH4+, то большая часть глутамата образуется путем последовательных реакций, катализируемых глутамин-синтетазой и глутамат-синтазой. Суммарная реакция описывается следующим уравнением;
NH4+ + α-Оксоглутарат + NADPH + АТР → L-Глутамат + NADP+ + ADP + Pi.
Обратите внимание, что стехиометрия этой реакции отличается от реакции, катализируемой глутамат-дегидрогеназой: здесь гидролизуется АТР. Почему этот более дорогой путь иногда используется E. coli? Ответ заключается в том, что Км глутамат-дегидрогеназы для NH4+ высока (-1 мМ), поэтому фермент не насыщается субстратом при недостаточной концентрации NH4+. Г лутамин-синтетаза имеет, наоборот, чрезвычайно высокое сродство к NH4+.