БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 36. МЕМБРАННЫЙ ТРАНСПОРТ
36.6. Натрий-калиевый насос - олигомерный трансмембранный белок
(Nа+ + К+)-АТРаза представляет собой тетрамер α2β2 массой 270 кДа. Большая а-субъединица (95 кДа) содержит участок, осуществляющий гидролиз АТР, и участок связывания кардиотонических стероидных ингибиторов. Меньшая β-субъединица (40 кДа) содержит углеводные группы. Между двумя α-субъединицами или между α и β-субъединицами (но не между двумя β-субъединицами) легко образуются поперечные мостики. Исходя из этого факта, можно было предположить, что α-субъеди- ницы контактируют друг с другом, тогда как β-субъединицы пространственно разделены. Как уже упоминалось, гидролиз АТР протекает на той стороне мембраны, которая обращена к цитозолю, а участок связывания стероидных ингибиторов находится на наружной стороне мембраны. Следовательно, каждая α-субъединица пронизывает мембрану насквозь (рис. 36.7). Углеводные цепи β-субъединиц расположены на наружной стороне плазматической мембраны, как это вообще свойственно мембранным гликопротеинам (разд. 10.12).
Рис. 36.7. Схематическое изображение субъединичной структуры и расположения в мембране (Nа+ + К+)-насоса
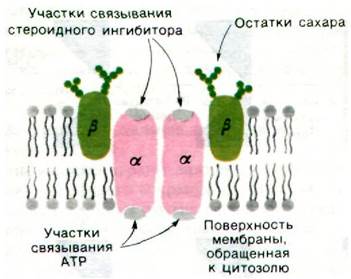
Любопытно отметить, что рассматриваемый ферментный комплекс обладает одним участком связывания стероидных ингибиторов, одним участком фосфорилирования и тремя участками связывания Na+. Как же получается, что тетрамер с субъединичной структурой α2β2 содержит нечетное число связывающих участков? Одна из возможностей состоит в том, что участки связывания расположены между субъединицами, в месте их контактов. Вспомним, что α2β2-тетрамер гемоглобина содержит единственный участок связывания бисфосфоглицерата, находящийся в полости, расположенной в центре молекулы (разд. 4.14). Однако существует и иная возможность, а именно такое взаимодействие двух ар-половин фермента, при котором связывание в одном из двух участков препятствует связыванию в другом. В самом деле, целый ряд олигомерных ферментов проявляет такую половинную реакционноспособность.
36.7. Модель механизма действия натрий-калиевого насоса
Почему фосфорилирование и дефосфорилирование АТРазы приводят к переносу Na+ и К+ через мембрану? Структура этого насоса еще не настолько изучена, чтобы можно было детально описать механизм его действия. Все же полезно рассмотреть простую модель работы насоса, предложенную Олегом Ярдецким (Oleg Jardetzky). Согласно этой модели, структура белка, функционирующего в качестве насоса, должна отвечать трем условиям.
1. В белке должна быть полость такой величины, чтобы в ней умещались небольшая молекула или ион.
2. Белок должен существовать в двух конформациях, причем при одной из них полость должна быть открыта со стороны, обращенной внутрь, а при другой - со стороны, обращенной наружу.
3. Указанные конформации должны иметь разное сродство к транспортируемым компонентам.
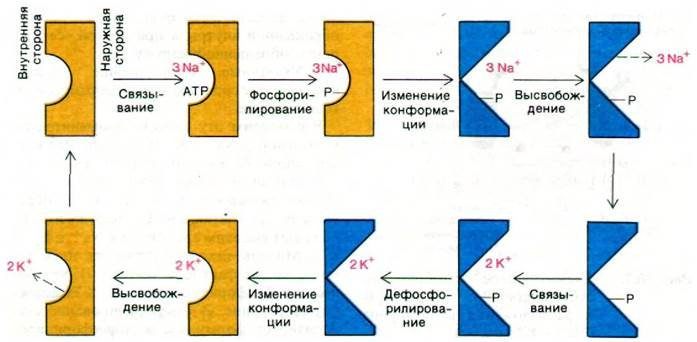
Рассмотрим эту модель применительно к транспорту Nа+ и К+ (рис. 36.8). Две конформации белка - это формы Е1 и Е2, уже описанные ранее. Постулировано, что 1) связывающая ионы полость на Е1 обращена внутрь клетки, а на Е2 - наружу и 2) Е1 обладает высоким сродством к Nа+, а Е2 - к К+. Модель исходит также из двух установленных фактов, а именно 1) Nа+ запускает фосфорилирование, а К+ - дефосфорилирование, 2) фосфорилирование стабилизирует форму Е2, а дефосфорилирование - форму Е1. На рис. 36.8 Е1 и Е2изображены совершенно разными по конформации. Нужно, однако, подчеркнуть, что структурные различия между этими двумя формами вовсе необязательно должны быть большими. Сдвига нескольких атомов на расстояние 2 А может оказаться достаточно, чтобы изменить ориентацию полости и сродство к Nа+ или К+. Существует множество прецедентов, позволяющих считать, что фосфорилирование способно вызвать изменения такого масштаба. Вспомним влияние фосфорилирования на свойства гликоген-фосфорилазы и гликоген-синтазы или на изменение сродства гемоглобина к кислороду при нековалентном связывании бисфосфоглицерата.
Рис. 36.8. Схематическое изображение предполагаемого механизма действия (Na+ + К+)-насоса. На верхней половине рисунка последовательность реакций, направленных на выведение трех ионов Nа+; ниже — последовательность реакций, обеспечивающих вход двух ионов К+. Формы Е1 (желтый цвет) и Е2 (синий цвет) на рисунке сильно различаются по конформации. На самом деле конформационные различия могут быть очень небольшими
36.8. Кардиотонические стероиды - специфические ингибиторы (Na+ + К+)-АТРазы и (Nа+ + К+)-насоса
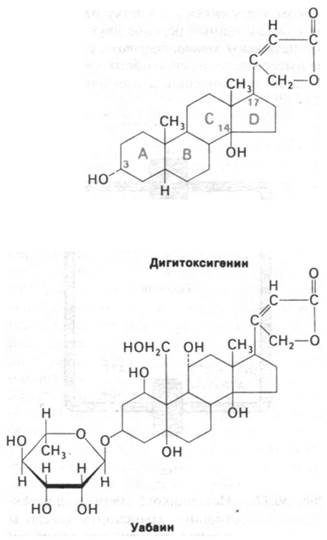
Некоторые стероиды растительного происхождения являются мощными ингибиторами (Nа+ + К+)-АТРазы и насоса. Полумаксимальное ингибирование обоих процессов наблюдается при концентрации ингибитора порядка 10-8 М. Представители этого класса ингибиторов, в частности дигитоксигенин и уабаин, называются кардиотоническими стероидами в связи с их выраженным действием на сердечную деятельность (рис. 36.9). Активность кардиотонических стероидов определяется наличием в их структуре 5- или 6-членного ненасыщенного лактонного кольца с β-конфигурацией при С-17. Существенное значение имеют также гидроксильная группа при С-14 и цис-конфигурация сочленения колец С и D. В молекуле уабаина и ряда других кардиотонических стероидов при С-3 находится остаток сахара, однако этот сахар не имеет значения для ингибирования АТРазы.
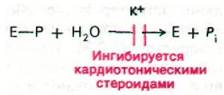
Рис. 36.9. Кардиотонические стероиды, например, дигитоксигенин и уа- баин, ингибируют (Na+ + К+)-насос
Как уже упоминалось, кардиотонические стероиды ингибируют реакцию дефосфорилирования (Na+ + К+)-АТРазы. Ингибирование присходит только в том случае, если кардиотонические стероиды локализованы на наружной стороне мембраны. Таким образом, подавление дефосфорилирования этими стероидами пространственно так же асимметрично, как и активация дефосфорилирования ионами калия.
Кардиотонические стероиды, например, дигиталис, имеют огромное значение в медицине. Дигиталис повышает силу сокращения сердечной мышцы и потому служит основным средством лечения острой сердечной, недостаточности. Ингибирование дигиталисом (Na+ + К+)-насоса приводит к повышению содержания Na+ в клетках сердечной мышцы. Это сопровождается увеличением внутриклеточной концентрации Са2+, что в свою очередь повышает сократительную активность миокарда. Любопытно отметить, что дигиталис (алкалоид наперстянки) успешно использовался задолго до открытия (Na+ + К+)-АТРазы. В 1785 г. врач и ботаник Уильям Уитеринг (William Withering) опубликовал «Описание наперстянки и некоторые способы ее применения в медицине», где рассказывает, каким образом он впервые узнал об использовании дигиталиса для лечения острой сердечной недостаточности.
«В 1775 г. меня спросили, каково мое мнение о домашнем способе лечения водянки. При этом сообщили, что этот способ был известен одной старухе в Шропшире и она долго держала его в секрете. Старуха иногда вылечивала больных, которым не могли помочь врачи... Ее снадобье состояло из 20 или более различных трав, однако разбирающемуся в этом предмете нетрудно было заметить, что активным началом могла быть только наперстянка... Наперстянка влияет на биение сердца в большей степени, чем какое-либо из других лекарств, и это действие можно с успехом использовать для исцеления больного».