БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 36. МЕМБРАННЫЙ ТРАНСПОРТ
36.15. Антибиотики-переносчики имеют форму скорлупы ореха и связывают ионы в своей центральной полости
По данным рентгеноструктурного анализа и спектроскопических исследований, антибиотики - подвижные переносчики ионов - характеризуются определенной общностью структуры. Все исследованные к настоящему времени переносчики по форме напоминают скорлупу ореха. Единственный связываемый ион металла образует координационные связи с несколькими атомами кислорода, окружающими центральную полость. Число таких атомов кислорода (связывающих ион металла) обычно равно 6 или 8. Периферическая часть структуры подвижного переносчика состоит из углеводородных групп (рис. 36.23).
Рис. 36.23. Схематическое изображение хелатирования К+ атомами кислорода в транспортном антибиотике - подвижном переносчике
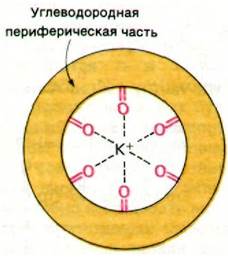
Функция центрально расположенных атомов кислорода, окруженных углеводородным наружным слоем, вполне очевидна. В самом деле, в водной среде ион металла, например, К+, связывает через кислород несколько молекул воды. Антибиотик-переносчик конкурирует с молекулой воды за связывание иона, образуя с ним хелатное соединение через несколько соответствующим образом расположенных атомов кислорода в центральной полости. Благодаря углеводородной периферической части переносчика его комплекс с ионом растворим в липидах мембран. По существу, каталитическое действие рассматриваемых антибиотиков на транспорт ионов через мембраны и состоит в том, что они переводят ионы в растворимую в липидах форму.
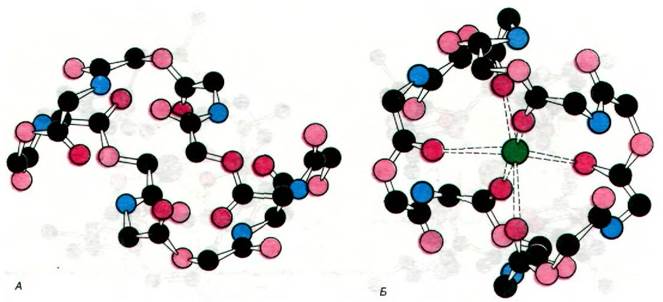
На рис. 36.24 показаны структуры валиномицина и его комплекса с К+. Ион К+ координирован с шестью атомами кислорода, описывающими октаэдр вокруг центральной полости молекулы. Эти атомы кислорода принадлежат карбонильным группам шести остатков валина в антибиотике. Метильные и изопропильные боковые цепи формируют углеводородную наружную часть молекулы валиномицина.
Рис. 36.24. Модели валиномицина (А) и его комплекса с К+ (Б). При связывании К+ происходит изменение конформации антибиотика
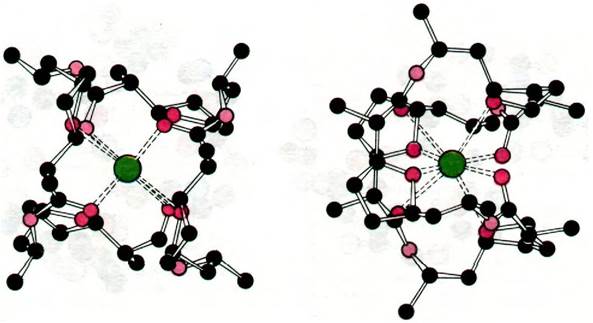
Интересна также структура комплекса с К+ другого переносящего ионы антибиотика, а именно нонактина (рис. 36.25). В этом комплексе К+ связан с восемью атомами кислорода в центре молекулы. Четыре атома кислорода из восьми принадлежат карбоксильным группам, а остальные четыре - эфирным связям.
Рис. 36.25. Вид с двух сторон модели комплекса нонактина с К+
36.16. Валиномицин связывает К+ в 1000 раз прочнее, чем Na+
Каким образом соединения, транспортирующие ионы, различают такие сходные ионы, как Nа+ и К+? Валиномицин связывает К+ в 1000 раз прочнее, чем Nа+, т.е. избирательность этого переносчика выше, чем у (Nа+ + К+)-АТРазы. Рассмотрим основу столь высокой избирательности. Как показали спектроскопические исследования, комплексы валиномицина с Nа+ и К+ очень сходны по структуре. В частности, в обоих комплексах одинаковы длины координационных связей между катионом в центре молекулы и атомами кислорода. Почему же тогда К+ связывается намного прочнее, чем Nа+? Причина этой избирательности в том, что К+ слабее, чем Nа+, притягивает воду. Свободная энергия образования гидратной оболочки для Nа+ на 17 ккал/моль ниже, чем для К+ (табл. 36.2). Следовательно, валиномицин связывает К+ прочнее потому, что отделение воды от К+ требует меньшей затраты энергии, чем отделение Nа+.
Таблица 36.2. Свойства щелочных катионов
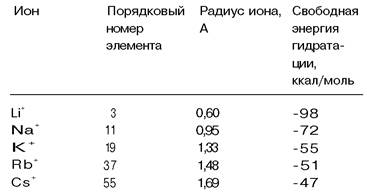
Пока еще не проводилось исследования атомарной структуры какого-либо ион- транспортирующего соединения, предпочтительно связывающего Na+, однако можно представить себе, каким должна быть ключевая особенность такой структуры. По- видимому, в ней должно отражаться использование того факта, что Na+ имеет меньший ионный радиус (г = 0,95 А), чем К+ (г = 1,33 А), благодаря чему отрицательно заряженные атомы кислорода могут в большей степени приблизиться к Na+, чем к К+; таким путем может быть преодолен более высокий энергетический барьер дегидратирования Na+ но сравнению с К+. Следовательно, можно предсказать, что участки специфического связывания Nа+ должны обладать высокой плотностью отрицательного заряда и такой геометрией, которая позволяла бы Nа+ плотно входить в них. В отличие от этого участки специфического связывания К+ должны, по-видимому, обладать отрицательным зарядом меньшей плотности и их геометрия должна меньше подходить для образования очень коротких связей между катионом и координирующими группами.
Примечательна также гибкость молекулы валиномицина (рис. 36.24). Хелатирование К+ представляет собой ступенчатый процесс, в ходе которого молекулы воды гидратной оболочки иона последовательно вытесняются кислородными атомами антибиотика. Новые связи формируются по мере разрыва старых, и потому активационный барьер для связывания иона оказывается низким. Аналогичным образом и энергия активации противоположного процесса - высвобождения иона - также низка. В итоге валиномицин присоединяет и высвобождает К+ множество раз на протяжении секунды. Важная роль гибкости структуры в этом случае так же очевидна, как и при действии ферментов.
36.17. Можно выявить поток ионов через единичный канал в мембране
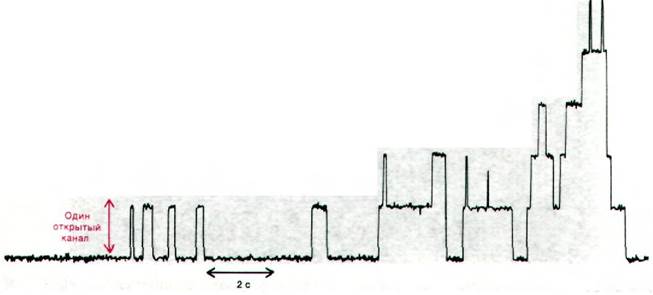
Проводимость планарной двуслойной мембраны, содержащей небольшое количество грамицидина А, не является постоянной. Как показал Денис Хейдон (Denis Haydon), проводимость этой мембраны для Na+ изменяется во времени ступенчато (рис. 36.26). Эти ступени проведения иона определяются спонтанным открыванием и закрыванием образованных грамицидином А каналов. Единичный канал остается открытым в течение примерно секунды. По такому каналу легко проходят одновалентные катионы, но не анионы или двухвалентные катионы. Оказалось, что по одному каналу в течение секунды мажет, пройти более 10 ионов. Такая скорость транспорта только на один порядок величины ниже скорости диффузии в чистой воде. В отличие от этого максимальная скорость транспорта, осуществляемого подвижным переносчиком, составляет менее103 ионов в 1 с, так как повороты и перемещение подвижного переносчика в мембране занимают не менее 1 мс.
Рис. 36.26. Ступенчатое изменение проводимости липидной двуслойной мембраны, содержащей несколько молекул грамицидина А. Минимальное увеличение проводимости обусловлено появлением одного открытого канала
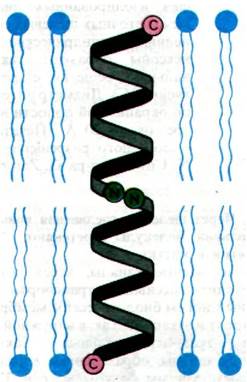
Методами спектроскопии и дифракции рентгеновских лучей было показано, что трансмембранный канал образуется из двух молекул грамицидина А (рис. 36.27). Внутри мембраны обладающий свойством проводника спирализованный димер находится в равновесии с непроводящими мономерами. По существу, ступенчатое изменение проводимости на рис. 36.26 соответствует процессу образования и диссоциации димеров. Димер формирует обводненный канал диаметром 4 А, окруженный полярными группами пептидов. Гидрофобные боковые цепи располагаются на периферии канала и контактируют с углеводородными цепями фосфолипидов мембраны. Окружающие водную пору карбоксильные группы в канале образуют кратковременные координационные связи с катионом в момент его прохождения по каналу. Как показал рентгеноструктурный анализ, связавший катионы канал, становится короче и шире; это еще раз подчеркивает динамическую природу молекул, обладающих транспортной функцией.
Рис. 36.27. Схематическое изображение канала из грамицидина А. Канал образуется путем связывания N-формильных концов двух полипептидов. Каждая цепь скручивается в β-спираль, похожую на свернутый в рулон β-складчатый слой