БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 37. ВОЗБУДИМЫЕ МЕМБРАНЫ И СЕНСОРНЫЕ СИСТЕМЫ
37.11. К числу нейромедиаторов относятся также катехоламины и γ-аминомасляная кислота (ГАМК)
Помимо ацетилхолина, известны и другие нейромедиаторы. Вещество считается нейромедиатором, если оно удовлетворяет следующим критериям. Во-первых, микроинъекции предполагаемого нейромедиатора в синаптическую щель должны вызывать такой же ответ, как возбуждение пресинаптического нерва. Во-вторых, это вещество должно в больших количествах присутствовать в пресинаптических нервных окончаниях. В этом отношении наиболее весомым критерием служит выделение синаптических пузырьков, содержащих это вещество. В-третьих, постулированный медиатор должен высвобождаться из пресинаптического нерва в нужное время и в количестве, достаточном для воздействия на постсинаптический нерв.
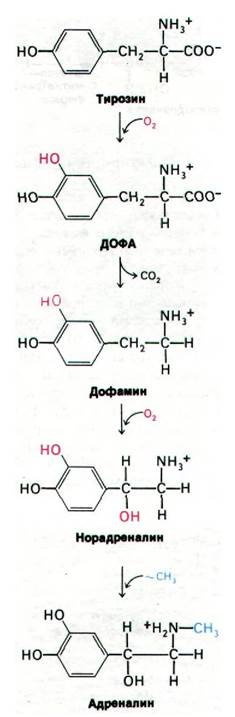
Этим критериям удовлетворяет ряд катехоламинов. Так, норадреналин является медиатором в гладкомышечных соединениях, которые иннервируются симпатическими нервами (в отличие от парасимпатических соединений, в которых нейромедиатором служит ацетилхолин). Катехоламины адреналин и дофамин - два других катехолами- новых нейромедиатора. Указанные катехоламины синтезируются из тирозина в окончаниях симпатических нервов и в надпочечниках (рис. 37.18). Первый этап синтеза (реакция, лимитирующая скорость всего процесса) -гидроксилирование тирозина с образованием 3,4-дигидроксифенилаланина (ДОФА). Данная реакция катализируется тирозин-гидроксилазой - ферментом, аналогичным фенилаланин-гидроксилазе. Активатором молекулярного кислорода при этом служит тетрагидробиоптерин - кофактор фермента. Второй этап синтеза - декарбоксилирование ДОФА, катализируемое ДОФА-декарбоксилазой (ферментом, содержащим пиридоксальфосфат) с образованием 3,4-дигидроксифенилэтиламина (дофамина). Далее дофамин гидроксилируется в норадреналин в присутствии медьсодержащей гидроксилазы. Наконец, из норадреналина в результате метилирования образуется адреналин; фермент, осуществляющий эту реакцию, трансметилаза, использующая в качестве донора метильных групп S-аденозилметионин.
Рис. 37.18. Путь биосинтеза катехоламиновых нейромедиаторов
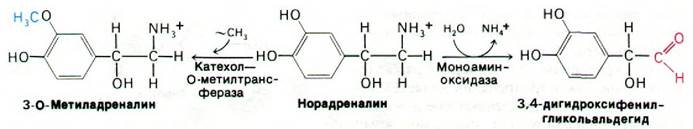
Инактивация катехоламиновых нейромедиаторов осуществляется путем метилирования 3-ОН-группы катехолового кольца. Реакцию катализирует катехол-О-метил- трансфераза, использующая S-аденозилметионин в качестве донора метильной группы. Другой путь инактивации этих нейромедиаторов - удаление аминогруппы в ходе окисления моноаминоксидазой (рис. 37.19).
Рис. 37.19. Инактивация норадреналина
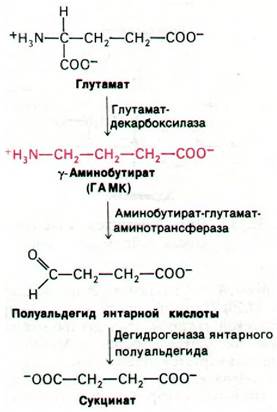
Среди производных аминокислот выявлен еще один нейромедиатор. Это у-амино- бутират, называемый также γ-аминомасля- ной кислотой (ГАМК). ГАМК увеличивает проницаемость постсинаптических мембран для К+ и тем самым отдаляет мембранный потенциал от порогового уровня, при котором возникает потенциал действия; таким образом, ГАМК - это тормозный нейромедиатор. ГАМК образуется при декарбок- силировании глутамата в реакции, катализируемой глутамат-декарбоксилазой (рис. 37.20). Нетрудно предугадать, что простетической группой этой декарбоксилазы служит пиридоксальфосфат. γ-Аминобутират инактивируется путем трансаминирования с образованием полуальдегида янтарной кислоты, который далее окисляется в сукцинат.
Рис. 37.20. Синтез и инактивация γ-аминобутирата
37.12. Для возбуждения палочки сетчатки глаза достаточно одного фотона
Рассмотрим теперь возбудимые рецепторы, активируемые светом. У человека имеются два типа фоторецепторных клеток, называемых палочками и колбочками в соответствии с их формой. Колбочки функционируют на ярком свету и ответственны за цветовое зрение, тогда как палочки воспринимают слабый свет, но не различают цвета. В сетчатке глаза человека содержится 3 млн. колбочек и 1 млрд. палочек. Эти фоторецепторные клетки преобразуют энергию света в движение атомов, а далее и в нервный импульс. Палочки и колбочки образуют синапсы с биполярными клетками, которые в свою очередь взаимодействуют с другими нервными клетками в сетчатке. Электрические сигналы, генерированные фоторецепторными клетками, преобразуются, проходя по сложной сети нервных клеток в сетчатке, и затем передаются в мозг по волокнам зрительного нерва. Таким образом, сетчатка выполняет две функции, а именно трансформирует свет в нервные импульсы и интегрирует зрительную информацию.
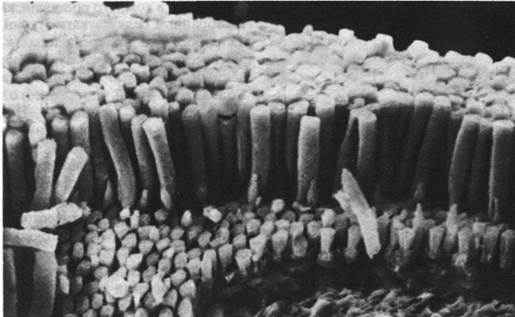
Рис. 37.21. Микрофотография клеток палочек сетчатки, полученная в сканирующем электронном микроскопе
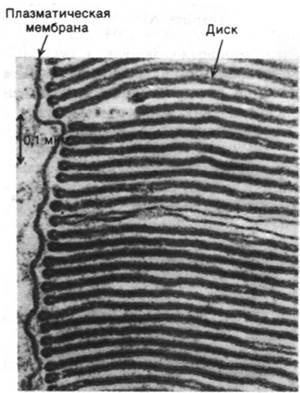
В 1938 г. Зелиг Хехт (Selig Hecht) открыл, что для возбуждения палочки (клетки) сетчатки человека достаточно одного фотона. Рассмотрим молекулярную основу исключительно высокой чувствительности этих клеток. Палочки представляют собой тонкие удлиненные структуры диаметром обычно 1 мкм и длиной 40 мкм. Основные функции этой клетки четко разделены пространственно (рис. 37.22). Наружный сегмент палочки специализирован для фоторецепции. В нем содержится примерно 1000 дисков, сложенных стопкой (рис. 37.23). Диски представляют собой закрытые уплощенные мешочки толщиной около 160 А. Эти мембранные структуры насыщены фоторецепторными молекулами. Мембраны дисков и плазматическая мембрана наружного сегмента не соприкасаются. Тонкая ресничка соединяет наружный сегмент с внутренним сегментом, богатым митохондриями и рибосомами. Во внутреннем сегменте с очень высокой скоростью вырабатывается АТР и идет активный синтез белков. Диски наружного сегмента имеют срок жизни всего лишь 10 дней и постоянно обновляются. Внутренний сегмент соприкасается с ядром, расположенным рядом с синаптическим тельцем. Синаптическое тельце, в котором содержится много синаптических пузырьков, образует синапс с биполярными клетками.
Рис. 37.22. Схематическое изображение палочки сетчатки
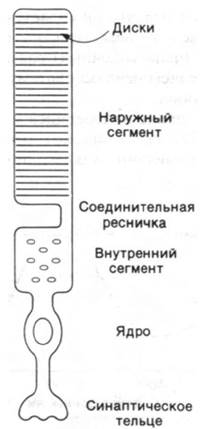
Рис. 37.23. Наружный сегмент палочки сетчатки под электронным микроскопом. Видны уложенные стопкой диски
37.13. Родопсин - фоторецепторный белок палочек
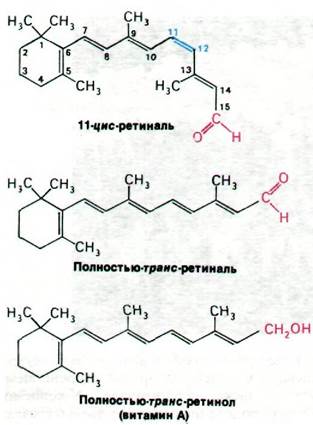
Для стимуляции фоторецепторных клеток необходимо поглощение света. Поглощение фотона света должно вызвать структурные изменения светопоглоoающей группировки(хромофора). Фоточувствительным веществом палочек является родопсин, состоящий из белка опсина и простетической группы, представленной 11-цис-ретиналем (рис. 37.24). Родопсин представляет собой трансмембранный белок массой 38 кДа. Его N-конец расположен в водной фазе внутри диска, а С-конец - на другой стороне мембраны диска, в цитозоле. N-концевая область родопсина содержит две олигосахаридные единицы, ковалентно присоединенные к аспарагиновой боковой цепи.
Рис. 37.24. Структура 11-цис-ретиналя, полностью-транс-ретиналя и полностью-транс-ретинола (витамина А)
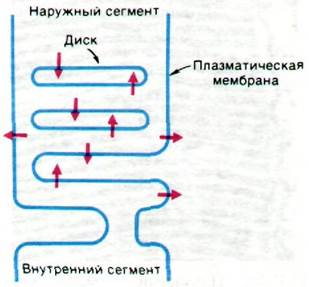
Этим сахарам, по-видимому, принадлежит важная роль в направленном передвижении родопсина из внутреннего сегмента к дискам. Дело в том, что родопсин, как и другие мембранные белки эукариот, синтезируется на рибосомах, прикрепленных к эндоплазматическому ретикулуму. Новосинтезированный родопсин попадает в аппарат Гольджи и лишь после этого достигает плазматической мембраны. Новые диски образуются в основании внутреннего сегмента путем инвагинации плазматической мембраны, и именно поэтому углеводные единицы родопсина оказываются локализованными внутри диска, хотя первоначально, входя в состав плазматической мембраны, они обращены во внеклеточное пространство (рис. 37.25).
Рис. 37.25. Образование дисков путем инвагинации плазматической мембраны. Стрелками показана полярность молекул родопсина
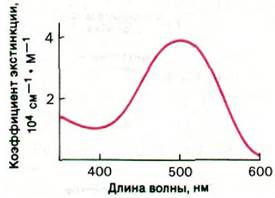
Опсин, подобно другим белкам, лишенным простетических групп, не поглощает видимого света. Цвет родопсина и его чувствительность к свету определяются присутствием 11-цис-ретиналя, являющегося высокоэффективным хромофором. Благодаря 11-цис-ретиналю родопсин обладает широкой полосой поглощения в видимой области спектра с максимумом при 500 нм, что прекрасно соответствует солнечному излучению. Примечательна также интенсивность поглощения видимого света родопсином. Коэффициент экстинкции родопсина при 500 нм очень высок, а именно 4 • 104 см-1 • М-1 (рис. 37.26). Суммарная сила поглощения видимого света родопсином приближается к максимальным значениям для органических соединений. Высокие хромофорные качества 11-цис-ретиналя обусловлены тем, что он является полиеном. Чередование в нем шести одинарных и двойных (ненасыщенных) связей создает длинную ненасыщенную систему для переноса электрона.
Рис. 37.26. Спектр поглощения родопсина
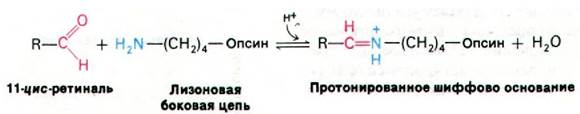
11-цис-ретиналь присоединен к родопсину через шиффово основание, которое образуется при связывании альдегидной группы 11-цис-ретиналя с ε-аминогруппой специфического остатка лизина в опсине. Спектральные свойства родопсина свидетельствуют о том, что шиффово основание находится в протонированной форме.
Предшественником 11-цис-ретиналя служит полностью-транс-ретинол (витамин А), который в организме млекопитающих не может синтезироваться de novo. Полностью-транс-ретинол (рис. 37.24) превращается в 11-цис-ретиналь в два этапа. Сначала происходит окисление спиртовой группы в альдегидную в присутствии ретинол-дегидрогеназы и NADP+в качестве акцептора электронов. Затем под действием ретиналь-изомеразы двойная связь между С-11 и С-12 изомеризуется из трансформы в цис-форму. Недостаточность витамина А приводит к ночной («куриной») слепоте и в конечном итоге к повреждению наружных сегментов палочек.