БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 25. ИНФОРМАЦИЯ РНК И ТРАНСКРИПЦИЯ
25.11. Транскрипция инициируется на промоторных участках матричной ДНК
Транскрипция начинается в определенных участках матричной ДНК, называемых промоторами. Как РНК-полимераза находит эти участки? Один из подходов к решению этой проблемы состоит в том, чтобы выделить те фрагменты, которые голофермент РНК-полимеразы защищает от расщепления панкреатической дезоксирибонуклеазой, и определить в этих фрагментах последовательность нуклеотидов. Другой подход сводится к тому, чтобы исследовать ряд мутантов с повышенной или пониженной интенсивностью транскрипции определенных генов. В результате таких исследований было установлено, что промоторные участки состоят примерно из сорока пар оснований, что соответствует фрагменту ДНК длиной примерно 140 А. Как показал анализ различных промоторов Е. coli и фагов, функцию сигнала узнавания в основном выполняет последовательность семи пар оснований, середина которой находится на расстоянии примерно 10 нуклеотидов перед точкой, с которой начинается кодирование мРНК (рис. 25.13). Второй участок узнавания расположен на расстоянии около 35 нуклеотидов перед точкой начала мРНК; он также участвует в первоначальном связывании РНК-полимеразы.
Рис. 25.13. Промоторные последовательности лактозного (4), галактозного (Б) и триптофанового (В) оперонов E. coli, фагов ![]() (I) и ɸХ174 (Д) и вируса SV-40 (Е). Предполагаемая область гомологии, так называемая последовательность Прибнова (Pribnow), показана зеленым
(I) и ɸХ174 (Д) и вируса SV-40 (Е). Предполагаемая область гомологии, так называемая последовательность Прибнова (Pribnow), показана зеленым

25.12. σ-Субъединица обеспечивает узнавание промоторных участков РНК- полимеразой
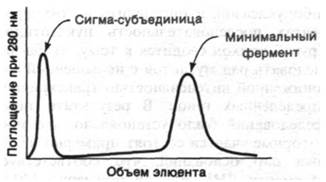
Кор-фермент (α2ββ') РНК-полимеразы не может начинать транскрипцию в промоторных участках. Для специфической инициации необходим голофермент α2ββ'σ. Роль сигма-субъединицы была открыта следующим образом. Если РНК-полимеразу очищали хроматографией на колонке с фосфоцеллюлозой, то она была практически лишена активности при использовании в качестве матрицы ДНК фага Т4, но сохраняла активность в опытах с ДНК из тимуса теленка. Наряду с этим та же РНК- полимераза, очищенная центрифугированием в градиенте концентрации глицерола, была, напротив, весьма активна на обеих матрицах. Из этого наблюдения можно было сделать вывод, что в препарате РНК- полимеразы, очищенной на фосфоцеллюлозе, не хватает какого-то фактора. Так оно и было (рис. 25.14). Активность фермента, очищенного на фосфоцеллюлозе, значительно увеличивается при добавлении другой фракции, элюирующейся с колонки. Этот стимулирующий фактор сам по себе не обладает каталитической активностью. Он был назван сигма σ-фактором. Последующие эксперименты показали, что фермент, очищенный на фосфоцеллюлозе, лишен σ-субъединицы, тогда как фермент, очищенный в глицероле, содержит ее. Таким образом, препарат, проявлявший максимальную активность при использовании в качестве матрицы ДНК фага Т4, представлял собой голофермент α2ββ'σ, а кор-фермент α2ββ' был не в состоянии транскрибировать эту ДНК. Добавление σ-субъединицы к кор-ферменту приводило к реконструкции вполне активного голофермента. Кор-фермент обладал способностью транскрибировать ДНК тимуса теленка, так как эта матрица содержит много одноцепочечных разрывов. РНК, синтезированная кор-полимеразой in vitro, не соответствует транскриптам, образующимся in vivo. В частности, кор-фермент транскрибирует обе цепи фаговых ДНК-матриц, тогда как голофермент транскрибирует асимметрично одну цепь, как он это делает in vivo.
Рис. 25.14. Разделение РНК-полимеразы на σ-субъединицу и кор-фермент (минимальный фермент; α2ββ') на колонке с фосфоцеллюлозой
Сигма-субъединица обеспечивает специфическую инициацию, снижая в 10 раз сродство РНК-полимеразы к ДНК, не содержащей промоторов. Кроме того, сигма-субъединица активирует узнавание промоторных последовательностей РНК-полимеразой. Наконец, сигма-субъединица участвует в раскрывании двойной спирали ДНК, так чтобы одна из цепей могла служить матрицей. При связывании голофермента РНК-полимеразы расплетается примерно один виток спирали ДНК. Так происходит подготовка фермента к образованию первой фосфодиэфирной связи новой цепи РНК.
После того как начинается синтез новой цепи РНК, сигма-субъединица отделяется от голофермента. Кор-фермент продолжает транскрибировать матрицу ДНК. Таким образом, функция голофермента — поиск промотора и инициация, а функция кор-фермента - элонгация. Отделившаяся сигма-субъединица присоединяется к другой молекуле кор-полимеразы, чтобы участвовать в инициации нового цикла транскрипции.
Инициация новых цепей РНК регулируется многими способами. Некоторые промоторные последовательности обеспечивают высокую эффективность инициации, другие менее эффективны. Кроме того, эффективность инициации регулируется белками, которые связываются с самим промоторным участком или рядом с ним. Репрессоры блокируют транскрипцию, препятствуя связыванию РНК-полимеразы, а факторы положительной регуляции способствуют инициации, облегчая связывание РНК-полимеразы. Эти важные регуляторные механизмы мы рассмотрим подробнее в гл. 28.
25.13. Цепи РНК начинаются с pppG или рррА
Большинство новосинтезированных цепей РНК содержат своего рода ярлычок, который показывает, с чего начался их синтез. Новые цепи РНК имеют строго определенную структуру 5'-конца: молекула начинается либо с рррА, либо с pppG. В отличие от синтеза ДНК затравка в этом случае не нужна. Цепи РНК могут образовываться de novo.
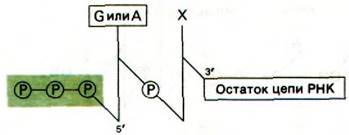
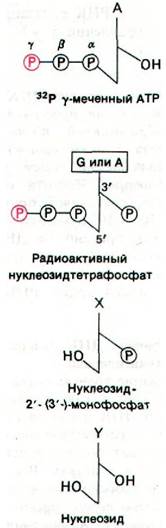
Этот ярлычок на 5'-конце был открыт двумя способами. Было обнаружено, что цепи РНК включают 32Р, если инкубационная смесь содержит меченный по γ-атому 32Р-АТР. Очевидно, что включенная метка должна быть локализована на конце, так, как только α-атом фосфора нуклеозидтрифосфата может участвовать в образовании внутренних фосфодиэфирных мостиков РНК. Кроме того, при щелочном гидролизе новосинтезированной РНК образуются продукты трех типов: нуклеозиды, нуклеозид-2'-монофосфаты (или нуклеозид-3'-монофосфаты) и нуклеозид- тетрафосфаты (рис. 25.15). Если в качестве субстрата использовали γ-32Р-AТР, образовывался аденозин-3'-фосфат-5'-три- фосфат. γ-Атом фосфора этого нуклеозидтетрафосфата содержал метку. Аналогичный результат был получен с γ-32Р-GТР. Однако, если взять γ-меченный СТР или UТР, радиоактивность не включается. Следовательно, новообразованная цепь РНК имеет трифосфатную группу на 5-конце и свободную ОН-группу на 3'-конце.
Рис. 25.15. Продукты щелочного гидролиза цепи РНК, меченной с помощью γ-32Р-AТР
25.14. Цепи РНК синтезируются в направлении 5'→ 3'
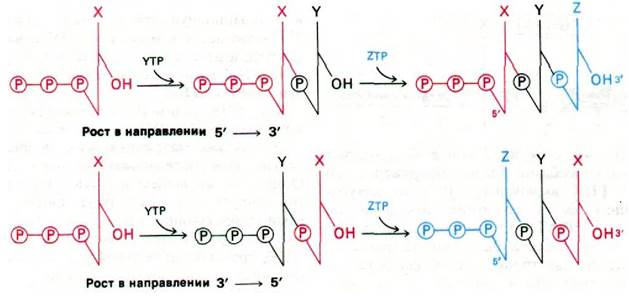
В каком направлении синтезируется РНК? В направлении 5' → 3' или 3' → 5'? Два противоположных механизма роста цепи проиллюстрированы на рис. 25.16. При росте в направлении 5' → 3' трифосфатный конец образуется в начале роста цепи, а при росте 3' → 5' трифосфатный конец появляется с последним включенным остатком. Кинетика включения радиоактивности в РНК, синтезированную из γ-32Р-GТР (или АТР), указывает, какая из этих возможностей имеет место. Если в качестве субстрата использовать γ-32Р-GТР, то отношение включения 32Р к общему включению нуклеотидов в продукт достигает максимума очень быстро после смешивания компонентов, а затем постепенно снижается во времени. При этом общая радиоактивность уже помеченной РНК не снижается при последующем добавлении большого избытка нерадиоактивного GТР в инкубационную смесь. Таким образом, 32Р включается в молекулу РНК в начале синтеза, а не в конце. Следовательно, рост цепи РНК идет в направлении 5' → 3', как при синтезе ДНК.
Рис. 25.16. Предполагаемое положение 32Р-метки в случае роста в направлении 5' → 3' и 3' → 5'. Наблюдаемое в действительности положение метки показывает, что РНК синтезируется в направлении 5' → 3'
Кор РНК-полимеразы движется вдоль цепи матричной ДНК в направлении 3' → 5', так как матричная цепь антипараллельна новосинтезированной цепи ДНК. Одна и та же молекула РНК-полимеразы синтезирует весь транскрипт - иными словами, транскрипция процессивна. По мере того как расплетается очередной участок ДНК, транскрибированный участок восстанавливает свою двухспиральную конформацию. Максимальная скорость элонгации составляет примерно 50 нуклеотидов в секунду.
Необходимо подчеркнуть, что РНК-полимераза не обладает нуклеазной активностью. В отличие от ДНК-полимеразы РНК-полимераза не проверяет правильности новообразованной полинуклеотидной цепи. В связи с этим надежность транскрипции значительно ниже, чем надежность репликации. Частота ошибок при синтезе РНК составляет примерно одну ошибку на 104-105 нуклеотидов, что в 105 раз выше, чем при синтезе ДНК. Гораздо более низкую надежность синтеза РНК клетка обходит тем, что с одного гена синтезируется много копий РНК-транскриптов.