БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 27. СИНТЕЗ БЕЛКА
27.18. Синтез белка терминируется факторами освобождения
Если А-участок рибосомы занят кодонами UAA, UGA или UAG, то связывания аминоацил-тРНК обычно не происходит. Нормальные клетки не содержат тРНК с антикодонами, комплементарными сигналам термииации. Их узнают белковые факторы освобождения. Один из этих факторов освобождения - RF-1 - узнает кодоны UAA или UAG. Второй фактор освобождения - RF-2 - узнает UAA или UGA. Таким образом, белки способны узнавать тринуклеотидные последовательности с высокой специфичностью.
Связывание одного из факторов освобождения с терминирующим кодоном в А-участке каким-то образом активирует пептидилтрансферазу, и она гидролизует связь между полипептидом и тРНК в Р- участке. Фактор освобождения изменяет специфичность пептидилтрансферазы таким образом, что акцептором активированного пептидильного остатка становится Н2О, а не аминогруппа. Затем полипептидная цепь покидает рибосому. 70S-рибосома диссоциирует на 30S- и 50S-субчастицы и приготавливается к синтезу новой белковой молекулы.
27.19. Многие белки модифицируются после трансляции
Многие полипептиды, образующиеся при трансляции мРНК, еще не окончательные продукты. Они могут быть впоследствии модифицированы различными способами.
1. Формильная группа на N-конце бактериальных белков гидролизуется деформилазой. Под действием аминопептидазы может произойти отщепление одного или нескольких N-концевых остатков. И у прокариот, и у эукариот концевой метионин иногда отщепляется в то время, когда синтез остальной полипептидной цепи еще продолжается.
2. При окислении двух цистеиновых остатков могут образоваться дисульфидные связи.
3. Боковые цепи некоторых аминокислот могут быть специфически модифицированы. Например, некоторые остатки про- лина и лизина в коллагене гидроксилируются. Гликопротеины образуются путем присоединения сахаров к боковым цепям аспарагина, серина и треонина. Некоторые белки фосфорилируются. К ферментам ковалентно присоединяются простетические группы, например, липоевая кислота.
4. Полипептидные цепи могут подвергаться специфическому расщеплению, например, при превращении проколлагена в коллаген и проинсулина в инсулин. Трансляция мРНК вируса полиомы дает очень длинную полипептидную цепь, которая гидролизуется с образованием нескольких белков.
27.20. Стрептомицин ингибирует инициацию и вызывает неправильное считывание информационной РНК
Мы уже видели, что антибиотики - чрезвычайно важный инструмент в биохимических исследованиях, так как действие многих антибиотиков весьма специфично. Например, рифампицин - мощный ингибитор инициации синтеза РНК (разд. 25.18). Известно много антибиотиков, ингибирующих синтез белка (табл. 27.3). В случае некоторых из них установлен и механизм действия. Стрептомицин - сильно основной трисахарид - препятствует связыванию формилметионил-тРНК с рибосомами и нарушает таким образом правильную инициацию белкового синтеза. Кроме того, стрептомицин вызывает неправильное считывание мРНК. Если в качестве матрицы используется роlу(U), то наряду с включением фенилаланина (UUU) происходит включение изолейцина (АUU). Место действия стрептомицина в рибосоме было определено в результате опытов по реконструкции компонентов рибосом из чувствительных и устойчивых к стрептомицину бактерий. Такие штаммы бактерий различаются мутацией в единственном гене. Чем же различаются эти рибосомы? Поскольку рибосомы можно диссоциировать и реконструировать in vitro, представлялась возможность выяснить, где расположен детерминант чувствительности к стрептомицину - в 50S- или 30S-субчастице. Гибридные рибосомы из 50S-субчастиц устойчивых бактерий и 30S-субчастиц чувствительных бактерий оказались чувствительными к стрептомицину, а рибосомы, полученные из субчастиц в обратной комбинации, устойчивы к нему. Этот эксперимент показал, что детерминант чувствительности к стрептомицину локализован в 30S-субчастице. Следующий эксперимент продемонстрировал, что чувствительность к стрептомицину определяется каким-то белком 30S-субчастицы, а не молекулой 16S-PHK. Наконец, после ряда сложных экспериментов оказалось, что чувствительность к стрептомицину детерминируется только одним белком, входящим в состав 30S-субчастицы S12.
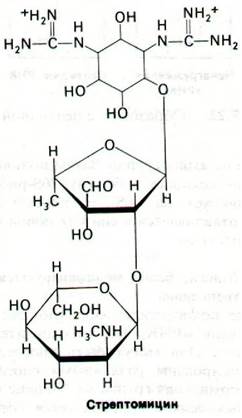
Таблица 27.3. Антибиотики - ингибиторы синтеза белка

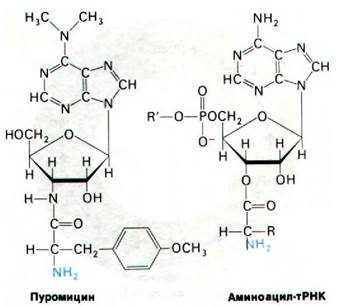
27.21. Пуромицин вызывает преждевременную терминацию цепи, так как имитирует амииоацилированную транспортную РНК
Антибиотик пуромицин ингибирует синтез белка, поскольку он освобождает новообразованные полипептидные цепи еще до того, как завершается их синтез. Пуромицин-аналог концевого участка аминоацил- тРНК аминоациладенозина (рис. 27.24). Он связывается с А-участком рибосомы и препятствует связыванию аминоацил-тРНК. Кроме того, пуромицин содержит α-аминогруппу. Эта аминогруппа, подобно аминогруппе аминоацил-тРНК, образует пептидную связь с карбоксильной группой растущей пептидной цепи в результате реакции, катализируемой пептидилтрансферазой. Образующийся продукт представляет собой пептид с ковалентно присоединенным остатком пуромицина на карбоксильном конце. Затем пептидилпуромицин сходит с рибосомы. Пуромицин был использован для изучения функционального состояния рибосом. Концепция существования А и Р-участков возникла в результате опытов с использованием пуромицина для выяснения локализации пептидил-тРНК. Когда пептидил-тРНК находится в А-участке (до транслокации), она не может вступать в реакцию с пуромицином.
Рис. 27.24. Структура пуромицина напоминает аминоацилированный конец аминоацил-тРНК