БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 24 ДНК: ГЕНЕТИЧЕСКАЯ РОЛЬ, СТРУКТУРА И РЕПЛИКАЦИЯ
24.16. Открытие ДНК-полимераз II и III
Мы видели, что ДНК-полимераза I может синтезировать и репарировать ДНК in vitro. Выполняет ли она эти функции in vivo? Вопрос вполне правомерный, так как фермент не всегда способен осуществлять in vivo ту реакцию, которую он катализирует in vitro. Условия, существующие в клетке, могут отличаться от условий, используемых при постановке опытов invitro, и, кроме того, в клетке могут присутствовать другие ферменты. Действительно, в клетке E. coli имеются по меньшей мере две другие ДНК- полимеразы, названные полимеразами II и III, которые были обнаружены примерно через 15 лет после открытия ДНК-полимеразы I. Чем же объясняется такое запаздывание? Дело в том, что активность ДНК-полимераз II и III маскировалась высокой активностью полимеразы I.
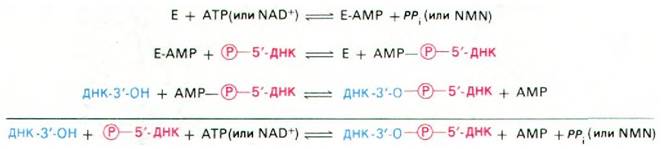
Рис. 24.32. Механизм реакции, катализируемой ДНК-лигазой
Ситуация изменилась в 1969 г., когда Паула Де Лусия и Джон Кэрнс (Paula DeLucia, John Cairns) выделили мутантную форму E. coli, в экстракте которого обнаруживалось от 0,5 до 1% нормальной полимеразной активности ДНК-полимеразы I по сравнению с обычными клетками. Этот мутант (обозначенный polA 1) размножался с такой же скоростью, как и родительский штамм. Кроме того, многие фаги размножались в клетках polA 1 так же хорошо, как и в родительских клетках. Однако этот мутант гораздо быстрее погибал под действием ультрафиолетового облучения. К тому же мутант polA 1 был более чувствителен к летальному действию химического мутагена метилметансульфоната. Де Лусия и Кэрнс сделали вывод, что репликация ДНК в клетках полученного ими мутанта polA 1 идет нормально, но репарация ДНК существенно нарушена. Они предположили, что для синтеза ДНК нужна какая-то другая полимераза, отличная от ДНК-полимеразы I.
Низкий фон активности полимеразы I у мутанта polA 1 облегчил поиск новых ДНК-полимераз. Вскоре в нескольких лабораториях были выделены и охарактеризованы два таких фермента. ДНК-полимеразы II и III подобны полимеразе I в следующих отношениях:
1. Они катализируют направляемый матрицей синтез ДНК из предшественников дезоксирибонуклеозидтрифосфатов.
2. Для проявления их активности необходима затравка со свободной 3'-ОН-группой,
3. Синтез идет в направлении 5' → 3'.
4. Они обладают 3' → 5'-экзонуклеазной активностью. ДНК-полимераза III (но не II) является также 5' → 3'-нуклеазой.
Эти полимеразы различаются по характеру предпочитаемых ими матриц. Для полимераз II и III оптимальными матрицами служат двухцепочечные ДНК, имеющие короткие одноцепочечные пробелы. Полимераза I, наоборот, предпочитает протяженные одноцепочечные участки, соседствующие с двухспиральными участками. Максимальные скорости катализа in vitro для этих ферментов также различаются: полимераза I присоединяет 10 нуклеотидов в секунду, а полимераза II - 0,5 и полимераза III - 150 нуклеотидов в секунду. В физиологически активном состоянии ДНК-полимераза III ассоциирована с некоторыми другими белками. Этот мультисубъединичный комплекс называют голоферментом ДНК- полимеразы III.
Какова роль этих полимераз in vivo? Вскоре мы расскажем о том, что мультиферментный комплекс, содержащий ДНК-полимеразу III, синтезирует большую часть новообразующейся ДНК, а ДНК-полимераза I удаляет затравку и заполняет пробелы. Роль ДНК-полимеразы II пока не установлена. Проведенные в последнее время биохимические и генетические исследования показали, что, кроме ДНК-полимераз I и II и ДНК-лигазы, для репликации ДНК в клетке E. coli необходимо более 10 белков. Прежде чем рассмотреть взаимодействие этих белков с ДНК, познакомимся в общих чертах с репликацией на уровне целой хромосомы.
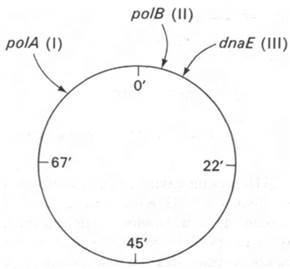
Рис. 24.33. Положение структурных генов трех ДНК-полимераз Е. coli. Ген ДНК-полимеразы I расположен в локусе polA, ген ДНК- полимеразы II - в локусе polB и ген ДНК-полимеразы III - в локусе dnaE
24.17. Расплетание родительской ДНК и синтез новой ДНК происходят в репликационной вилке
Изображения ДНК во время репликации были получены с помощью радиоавтографии и электронной микроскопии. При радиоавтографии изображение образуется в результате распада подходящего изотопа, например, трития. Испускаемые электроны взаимодействуют с гранулами серебра фотографической эмульсии. После проявления пленки возникают черные точки. Метод радиоавтографии имеет довольно низкую разрешающую способность - порядка нескольких сотен ангстрем. Однако у этого метода есть определенное преимущество: он позволяет видеть лишь те молекулы, которые содержат метку. Для того чтобы сделать ДНК видимой при радиоавтографии, в нее включают тимин или тимидин, меченный тритием.
На радиоавтографах и электронных микрофотографиях видно, что реплицирующаяся ДНК E. coli имеет форму замкнутого кольца с внутренней петлей (рис. 24.34). Молекулы такой формы называют тета-структурами, так как они напоминают греческую букву Ɵ(рис. 24.35). Тета-структуры показывают, что молекулы ДНК сохраняют во время репликации кольцевую форму. Разрешение этого метода недостаточно велико, чтобы различить свободные концы. Однако очевидно, что длинных нитей одноцепочечной ДНК в молекуле нет. Таким образом, эти изображения позволяют отвергнуть механизм репликации, согласно которому цепи родительской ДНК сначала полностью раскручиваются, и только затем используются в качестве матриц при синтезе новой ДНК. Напротив, синтез новой ДНК сопряжен с одновременным раскручиванием родительской ДНК. Участок, где происходит одновременное расплетание и синтез, называется репликационной вилкой.
Рис. 24.34. Радиоавтограф реплицирующейся ДНК Е. coli
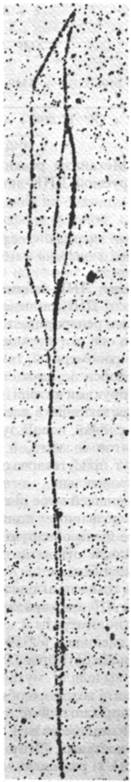
Рис. 24.35. Схематическое изображение кольцевой хромосомы Е. coli во время репликации. Синими линиями в этой тета-структуре показана родительская ДНК, красными - новообразованная ДНК

24.18. Репликация ДНК начинается в строго определенном месте и продолжается последовательно в обоих направлениях
Начинается ли репликация ДНК E. coli в произвольном месте хромосомы, или же в хромосоме имеется определенный участок инициации? Репликация ДНК - строго регулируемый процесс, поэтому a priori кажется гораздо более вероятным, что она начинается в определенном месте. Действительно, как показали работы по определению относительного числа различных генов в условиях быстрого синтеза ДНК, репликация в клетках E. coli начинается в одном определенном месте хромосомы. Рассмотрим два гена - а и b. Предположим, что ген а расположен вблизи от точки начала репликации, а ген b - вблизи от конца. Тогда ген а будет реплицироваться намного раньше, чем ген b. В быстро растущей культуре на один ген b будет приходиться примерно два гена а. Если же, наоборот, репликация ДНК начинается в случайной точке, количество генов а и b будет одинаковым. Относительное число генов было определено с помощью метода гибридизации, который рассматривается ниже (разд. 25.5). Результаты этих экспериментов ясно показали, что относительное число генов действительно зависит от их положения на карте (рис. 24.36). Эти данные позволили сделать следующие выводы.
Рис. 24.36. Относительные количества различных генов в условиях быстрого синтеза ДНК у Е. coli в зависимости от их положения на генетической карте
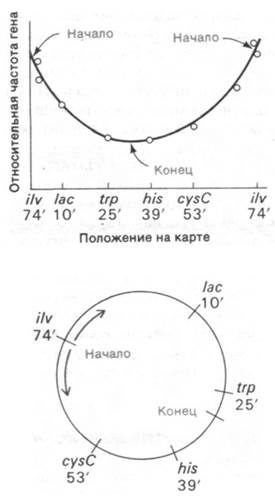
1. Репликация начинается в строго определенном уникальном участке - вблизи гена ilv, локализованного на 74' на стандартной генетической карте E. coli.
2. Репликация идет одновременно в обоих направлениях с примерно одинаковой скоростью. Другими словами, существуют две репликационные вилки: одна движется по часовой стрелке, другая - против часовой стрелки.
3. Две репликационные вилки встречаются вблизи маркера trp (25' на генетической карте) - в точке, почти диаметрально противоположной началу репликации.
Еще одно доказательство двунаправленности репликации ДНК у E. coli было получено методом радиоавтографии. Для этого вначале репликацию проводили в среде, содержавшей тимин, меченный тритием до умеренной удельной радиоактивности. Через несколько минут инкубации бактерии перенесли в среду, содержавшую высокомеченный тритием радиоактивный тимин. Пробы с двумя различными уровнями радиоактивности использовались для того, чтобы получить на радиоавтографах два типа цепочек зерен серебра: цепочки с низкой плотностью зерен, соответствующие ДНК, синтезированной вначале, и цепочки с высокой плотностью, соответствующие ДНК, синтезированной позже. Если бы репликация шла в одном направлении, были бы видны цепочки с высокой плотностью зерен на одном конце и низкой плотностью на другом. Если же репликация идет в двух направлениях, середина каждого отпечатка ДНК должна была бы иметь низкую плотность зерна, а концы - высокую (рис. 24.37). Радиоавтографы дали наглядный ответ (рис. 24.38). Цепочки зерен серебра (отпечатки ДНК) во всех случаях имели более высокую плотность зерен на обоих концах, чем посередине, указывая тем самым, что репликация хромосомы E. coli идет в двух направлениях.
Рис. 24.37. Предполагаемые результаты радиоавтографии в случае одно- и двунаправленной репликации, если бактерий переносят со среды, содержащей тимин с умеренной радиоактивностью, на среду с высокорадиоактивным тимином
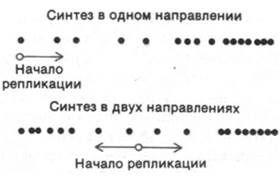
Рис. 24.38. Радиоавтограф ДНК Е. coli во время репликации (условия опыта указаны в подписи к рис. 24.37). Наблюдаемое распределение зерен серебра показывает, что репликация идет в двух направлениях
