БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 34. МЫШЕЧНОЕ СОКРАЩЕНИЕ И ПОДВИЖНОСТЬ КЛЕТОК
34.5. Актин образует нити, которые соединяются с миозином
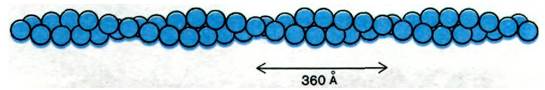
Актин - основной компонент тонких нитей. В растворах с низкой ионной силой актин существует в виде мономера массой 42 кДа, обозначаемого как G-актин (G от англ. globular - глобулярный). При повышении ионной силы до физиологического уровня G-актин полимеризуется в F-актин - фибриллярную форму, очень похожую на тонкие нити. На электронных микрофотографиях волокна Е-актина выглядят как две нити бус, закрученные одна вокруг другой (рис. 34.10). Рентгеноструктурный анализ показал, что F-актин представляет собой спираль из мономеров актина. Диаметр спирали - около 70 А. Структура состоит из повторяющихся участков длиной 360 А по оси спирали (рис. 34.11).
Рис. 34.10. Электронная микрофотография нити из очищенного F-актина
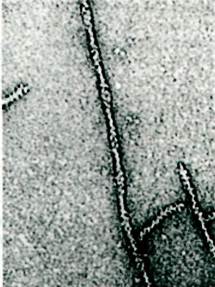
Рис. 34.11. Схематическое изображение F-актина, состоящего из спирально расположенных мономеров актина
При добавлении раствора актина к раствору миозина образуется комплекс этих белков актомиозин. Формирование этого комплекса сопровождается большим увеличением вязкости раствора. В 40-х годах Альберт Сент-Дьёрдьи показал, что возрастание вязкости обращается добавлением АТР. Так было выявлено, что АТР вызывает диссоциацию актомиозина на актин и миозин. Сент-Дьёрдьи получил также нити актомиозина, молекулы которого были ориентированы определенным образом током жидкости. Когда эти нити поместили в раствор, содержащий АТР, К+ и Mg2+, получился поразительный результат: актомиозиновые нити сократились. В тех же условиях нити, образованные из одного миозина, не сокращались. Эти замечательные опыты дали основание думать, что мышечное сокращение возникает в результате взаимодействия миозина, актина и АТР.
34.6. Актин повышает АТР-азную активность миозина
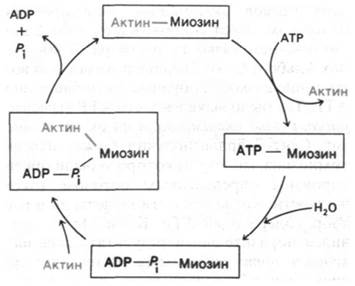
АТР-азная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Так, число оборотов увеличивается в 200 раз: от 0,05 до 10 с-1. Собственно гидролиз АТР чистым миозином идет очень быстро, но продукты реакции-ADP и Рi - высвобождаются медленно. Актин увеличивает число оборотов миозина, присоединяясь к комплексу миозин—ADP—Pi и ускоряя высвобождение ADP и Рi (рис. 34.12). После акта гидролиза актомиозин связывается с АТР, что
приводит к его диссоциации на актин и миозин. В результате вновь образуется комплекс миозин—АТР, входящий в новый каталитический цикл. Эти реакции идут с участием Mg2+. Важнейшая особенность рассматриваемого цикла, который был предложен Эдвином Тейлором (Edwin Taylor) на основе изучения быстрой кинетики процесса, состоит в том, что актин обладает высоким сродством к миозину и комплексу миозин—ADP—Pi, но низким сродством к комплексу миозин—АТР. Вследствие этого актин то присоединяется к миозину, то высвобождается из комплекса с ним - в зависимости от гидролиза ATР. Как будет показано ниже, это АТР-зависимое изменение во взаимодействии миозина и актина лежит в основе генерирования силы при мышечном сокращении.
Рис. 34.12. Гидролиз ATP приводит к циклическому образованию и распаду комплекса актина и миозина
34.7. Толстые и тонкие нити мышечного волокна определенным образом ориентированы
Циклический процесс образования и диссоциации комплекса миозина и актина создает координированное движение потому, что эти белки входят в состав высокоорганизованной системы. Путем изучения интактных миофиламентов, отделенных от мышцы, а также искусственных волокон, образованных из очищенного миозина, Хью Хаксли показал, как расположены молекулы миозина в толстых нитях. Выделенная из мышечного волокна толстая нить имеет диаметр 160 А и длину примерно 1,5 мкм (15 000 А). Вдоль нити периодически по спирали выступают поперечные мостики, и только в середине остается свободная от мостиков область протяженностью 1500 А (рис. 34.13).
Рис. 34.13. Электронная микрофотография реконструированной толстой нити. По обе стороны от свободной зоны видны выступающие поперечные мостики
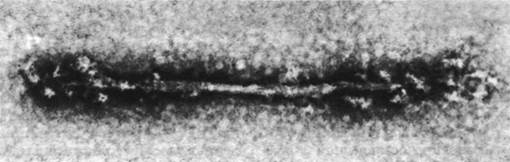
Аналогичную структуру имеют и искусственные толстые нити, образующиеся при снижении ионной силы раствора миозина. Длина наиболее короткой искусственной нити составляет около 3000 А, а расположенная в середине свободная от мостиков зона - 1500 А. Поскольку такая же протяженность свободной зоны свойственна и более длинным искусственным нитям, очевидно, что рост толстых нитей происходит путем добавления молекул параллельно к уже собранному ряду. Молекулы миозина, расположенные по одну сторону от свободной от мостиков зоны, ориентированы в одном направлении, тогда как молекулы по другую сторону ориентированы в противоположном направлении. Следовательно, толстые нити по самой своей природе биполярны.
ЛММ, подобно миозину, агрегирует в растворах с низкой ионной силой, образуя нити с периодической структурой, где длина повторяющегося участка составляет по оси 430 А, т. е. столько же, сколько составляет расстояние между поперечными мостиками в интактной толстой нити. Однако нити из ЛММ гладкие, без выступающих мостиков. Это показывает, что поперечные мостики образуются в ТММ-части миозина, тогда как ЛММ-единицы миозина образуют скелет толстых нитей.
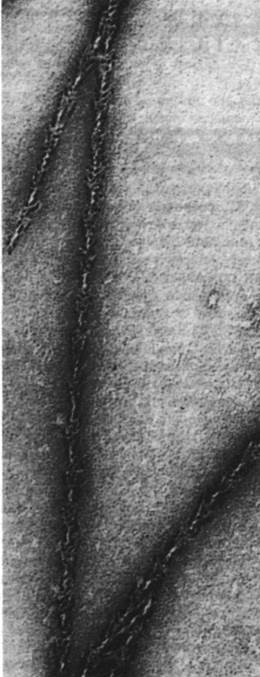
Тонкие нити также имеют определенное направление. Если миозин (или ТММ, или S1) добавить к тонким нитям или F-актину, то формируется структура, которая под электронным микроскопом выглядит как ряд последовательно расположенных стрелок (рис. 34.14). Такие структуры получили образное название декорированные нити. По всей длине декорированных нитей стрелки на обоих тяжах направлены в одну сторону. Таким образом, тонким нитям изначальноприсуща направленность, одинаковая на обоих тяжах, составляющих тонкую нить. В некоторых препаратах тонких нитей, полученных из гомогенизированных мышц, часть нитей сохраняет связь с Z-пластинкой. При декорировании таких препаратов тяжелым меромиозином стрелки на всех нитях оказались направлены в сторону от Z-пластинки. Отсюда следует, что все тонкие н ити по одну сторону от Z-пластинки ориентированы в одном направлении, тогда как нити, расположенные по другую сторону, в противоположном.
Рис. 34.14. Электронная микрофотография нити F-актина, декорированной S1-головками ТММ. Все стрелки ориентированы в одну сторону
.
34.8. Полярность толстых и тонких нитей в середине саркомера меняется на противоположную
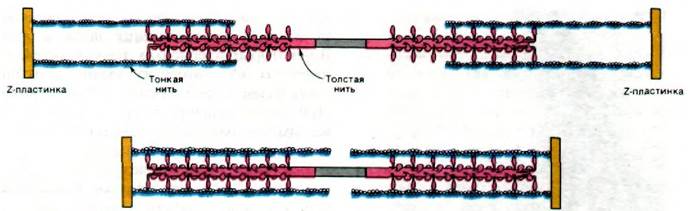
Полярность структуры толстых и тонких нитей играет решающую роль в координированном движении. Благодаря тому, что участки взаимодействия на нитях актина и миозина ориентированы одинаково по отношению друг к другу, в ходе скольжения нитей происходит сложение сил, развивающихся в каждом участке взаимодействия. Кроме того, посередине между двумя Z-пластинками направление нитей меняется на противоположное (рис. 34.15). В итоге две тонкие нити при взаимодействии с одной толстой скользят навстречу друг другу, что приводит к уменьшению расстояния между Z-пластинками (рис. 34.16).
Рис. 34.15. Перемена полярности толстых и тонких нитей посередине между двумя Z-пластинками
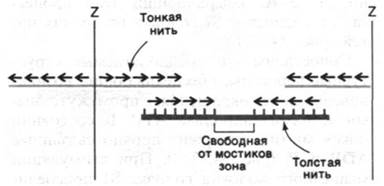
Рис. 34.16. Схема взаимодействия толстых и тонких нитей при сокращении скелетной мышцы