Структура и функционирование белков. Применение методов биоинформатики - Джон Ригден 2014
Предсказание функции белков на основе их теоретических моделей
Практическое применение
Предсказание специфичности к лигандам
Одно из самых основных предсказаний функции, которое может быть получено из модели белка, - это специфичность к лигандам. Зачастую если известна структура белка А связанного с лигандом X, интересно предсказать, будет ли белок В, гомологичный белку А, также специфичен к X или, на самом деле, он связывает другой лиганд Y. Такой анализ основывается на предположении, что связывающий сайт в белках А и В расположен одинаково. Обычно это верно для гомологичных белков и, в случае ферментов, подтверждается наличием поблизости ключевых каталитических остатков. Затем по шаблону структуры А создают структуру В, и изучение этой структуры, в частности, сравнение её со структурой А, показывает, появились ли изменения в сайте связывания. Уменьшение его размера, например, будет трактоваться, как уменьшение размера связываемого лиганда.
Примером одной из первых работ в этой области стало моделирование липид-связывающего белка мозга (англ. brain lipid binding protein, BLBP), основанное на структуре родственного белка, связывающего жирные кислоты (Xu et al. 1996). Взаимодействия известных жирных кислот с белком BLBP были смоделированы в исследовательских работах, направленных на установление молекулярных основ в двадцать раз более сильного связывания докозагексоеноевой кислоты по сравнению с более короткими олеиновой и арахидоновой кислотами. Модель показала, что два дополнительных атома у первой из этих кислот могут располагаться в кармане белка, усиливая благоприятное гидрофобное взаимодействие. Вычисленная дополнительная энергия связывания, основанная на величине дополнительной площади гидрофобного контакта, составляет около 2 ккал/моль и хорошо коррелирует с различием в аффинности этих кислот. Исходя из проверенной таким образом модели авторы смогли предсказать, что более длинные жирные кислоты не будут образовывать дополнительных контактов, и не будут поэтому иметь большую аффинность.
Молекулярные основы различной специфичности иногда могут быть на удивление простыми. Это как раз имеет место в случае с донорами фосфата в некоторых 6-фосфофруктокиназах - гликолитических ферментах, катализирующих перенос фосфогруппы донора, которыми могут быть АТФ, АДФ или неорганические пирофосфаты. АТФ- и пирофосфат-зависимые ферменты имеют эволюционную близость, в то время как АДФ-зависимые фосфофруктокиназы относятся к иному структурному классу. Ранее было отмечено, что АТФ-зависимые ферменты трипаносоматид более близки к определенным пирофосфат-зависимым ферментам, чем к хорошо известным АТФ-зависимым ферментам бактерий и млекопитающих (Michels et al. 1997). Позже моделирование позволило установить, что причина специфичности к АТФ или пирофосфату может быть указана с точностью до одного аминокислотного остатка, которым является Gly в АТФ-зависимых ферментах и Asp в пирофосфат-зависимых (Lopez et al. 2002). Как показано на Рис. 12.5, аспартат в этом положении имеет стерические и электростатические наталкивания с а-фосфатом связанной АТФ или АДФ, что уменьшает сайт связывания до размеров, подходящих только пирофосфату. Подтверждением этой впечатляюще простой причины специфичности стало превращение пирофосфат-зависимого фермента в АТФ-зависимый одной лишь заменой соответствующего аспартата на глицин (Chi and Kemp 2000).
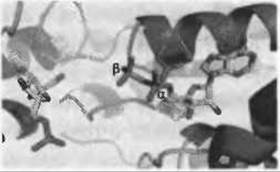
Рис. 12.5. (Цветную версию рисунка см. на вклейке.) Каталитический центр 6-фосфофруктокиназы Е. coli со связанным 6-фосфатом фруктозы и АДФ (PDB код 4pfk). Лиганды показаны цветными стержнями (6-фосфат фруктозы слева и АДФ справа). АТФ-зависимые ферменты, такие как этот, имеют глицин в каталитическом центре (не показан). Моделирование расположения аспартата в этом же положении (показан розовым), аналогично наблюдаемому в пирофосфат-зависимых ферментах, показывает, что этот остаток ответственен за изменение специфичности к донору фосфата (см. текст)