Структура и функционирование белков. Применение методов биоинформатики - Джон Ригден 2014
Методы биоинформатики для изучения структуры и функций неупорядоченных белков
Предсказание неупорядоченности
Методы предсказания на основе предрасположенности
С описанными выше методами близки по концепции другие методы прогнозирования на основе предрасположенностей, которые позволяют оценить, насколько часто определенное аминокислотное свойство, связанное с неупорядоченностью, встречается в данном предопределенном сегменте белка. В GlobPlot (binding et al. 2003a), например, применяют показатели, полученные с использованием шкалы, которая отображает предрасположенность данной аминокислоты к нахождению в неупорядоченной области либо в области правильной вторичной структуры. В DisEMBL (binding et al. 2003b) аналогичным образом используются три дополнительных свойства: “петли-кольца” (в соответствии с классификацией метода DSSP), “горячие петли” (петли с высокими В-факторами в кристаллографической структуре) и значений поля “REMARK 465”, которое описывает предрасположенность аминокислоты к отсутствию в рентгеновской структуре PDB.
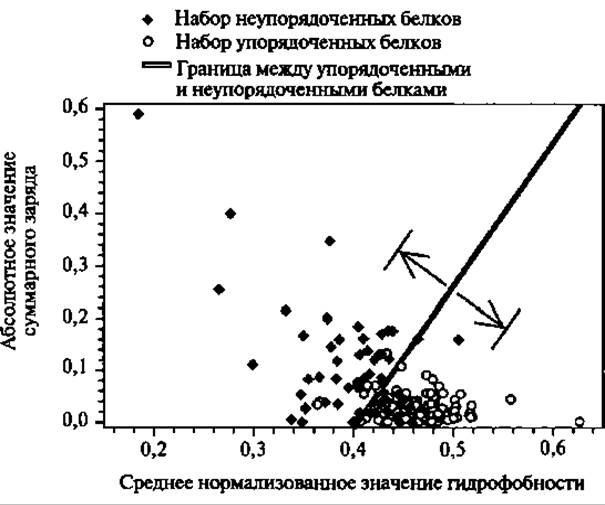
Рис. 5.1. Диаграмма распределения неупорядоченности белков. Для белков с присущей неупорядоченностью (показаны черными ромбами) и упорядоченных белки (показаны белыми кружками) показаны их суммарный заряд и средняя гидрофобность. Эти группы белков разделены прямой <заряд> = 2.743 <гидрофобность> - 1.109. Стрелки указывают на линии, ограничивающие зону с точностью предсказания 95% для неупорядоченных белков и 97% для упорядоченных за счет исключения из рассмотрения 50% от общего количества белков (Перепечатано с разрешения Oldfield 2005а. Copyright 2005 American Chemical Society)
Несколько иной подход для предсказания на основе предрасположенности применяется в Prelink (Coeytaux and Poupon 2005). В методе Prelink используются два свойства неупорядоченных областей (которые определены как области, связывающие глобулярные домены); аминокислотный состав, предрасполагающий к образованию неупорядоченности, и незначительное количество либо полное отсутствие гидрофобных кластеров. Для количественной оценки этих двух свойств было рассчитано распределение аминокислот в упорядоченных белках и неупорядоченных областях. В исследуемой последовательности с помощью метода автоматического анализа гидрофобных кластеров (automated Hyrdophobic Cluster Analysis, HCA) вычисляется расстояние до ближайшего гидрофобного кластера. Метод основан на двумерном спиральном представлении белковых последовательностей. В основе оценки неупорядоченности лежит как аминокислотный состав, так и полученное значение расстояния.
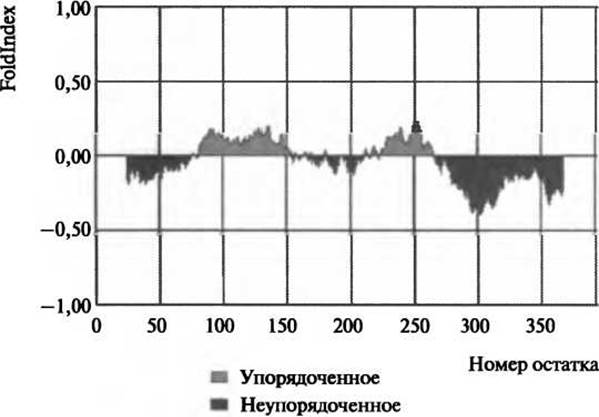
Рис. 5.2. Диаграмма величины Foldindex для неупоряченности белка р53. Неупорядоченность суппрессора опухоли р53 была предсказана по методу Foldindex (Prilusky et al. 2005). Темно-серым цветом показана предсказанная неупорядоченность, светло-серым - упорядоченность, что согласуется с биофизическими данными, которые предсказывают неупорядоченность в N-концевом транс-акгиваторном домене, С-концевом домене тетрамеризации и регуляторном домене (Bell et al. 2002; Dawson et al. 2003) (Перепечатано из Prilusky et al. 2005 с разрешения Oxford University Press)