Биохимия в таблицах схемах и графиках - С.Д. Жамсаранова 2009
Строение и характеристика протеиногенных аминокислот
Структура белков
Пептидные цеп и содержат десятки, сотни и тысячи аминокислотных остатков, соединенных прочными пептидными связями. За счет внутримолекулярных взаимодействий белки образуют определенную пространственную структуру, называемую «конформация белков». Различают 4 уровня структурной организации белков.
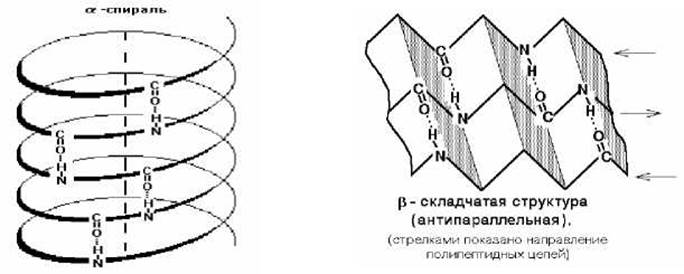
Первичная структура - это линейная последовательность аминокислотных остатков в полипептидной цепи.
Вторичная структура белков - это пространственная структура, образующаяся в результате взаимодействий между функциональными группами пептидного остова. При этом пептидная цепь может приобретать структуры двух типов: а-спирали и ß-структуры.
Третичная структура белка - это трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в пептидной цепи.
СВЯЗИ СТАБИЛИЗИРУЮЩИЕ ТРЕТИЧНУЮ СТРУКТУРУ ГЛОБУЛЯРНОГО БЕЛКА
Показаны только некоторые пары взаимодействующих радикалов
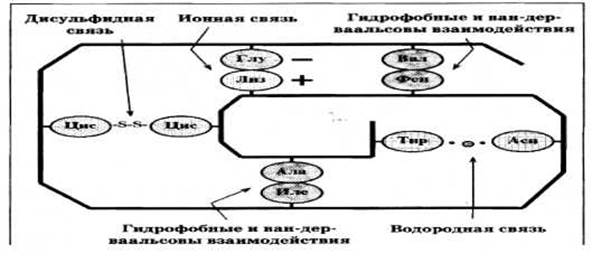
ТИПЫ РАДИКАЛОВ АМИНОКИСЛОТ И ОБРАЗУЕМЫЕ ИМИ СВЯЗИ
Типы радикалов |
Соответствующие аминокислоты |
Примерное содержание в белках |
Связи, образуемые радикалами |
Неполярные радикалы |
Гли, Ала, Вал, Лей, Иле, Фен, Три, Про |
50% |
«Гидрофобные» и Ван-дер-ваальсовы (индукционные и дисперсионные) взаимодействия |
Полярные радикалы неспособные к ионизации |
Сер, Тре, Цис, Тир, Асн, Глн |
20% |
Водородные связи, для Цис еще и дисульфидные связи |
Полярные радикалы способные к ионизации при физиологическом рН |
Асп, Глу, Арг, Лиз, Гис |
30% |
Ионные и водородные связи |
ТРЕТИЧНАЯ СТРУКТУРА ИНСУЛИНА
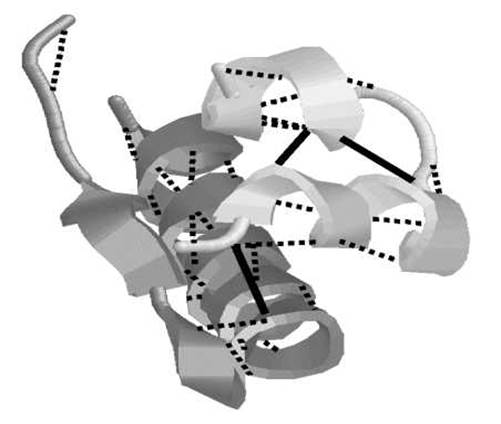
Спиралями представлены а-спиральные участки, цилиндрическими кривыми — нерегулярные участки. Пунктиром показаны водородные связи, а сплошными линиями — S-S-мостики.
НЕКОТОРЫЕ СЛОЖНЫЕ БЕЛКИ
Белки |
Простетическая группа |
Металлопротеины |
Ионы металлов |
Фосфопротеины |
Н3РО4 |
Гемопротеины |
Гемы |
Гликопротеины |
Моносахариды, олигосахариды |
Липопротеины |
Триацилглицерины и сложные липиды |
Нуклеопротеины |
|
Рибонуклеопротеины (рибосомы и др.) |
РНК |
Дезоксирибонуклеопротеины (хроматин) |
ДНК |
ПРОСТРАНСТВЕННАЯ ЧЕТВЕРТИЧНАЯ СТРУКТУРА ЧЕЛОВЕЧЕСКОГО ГЕМОГЛОБИНА
Гемоглобин - олигомерный белок. Основная функция гемоглобина - транспорт О2 из легких в ткани. Функция регулируется различными лигандами.
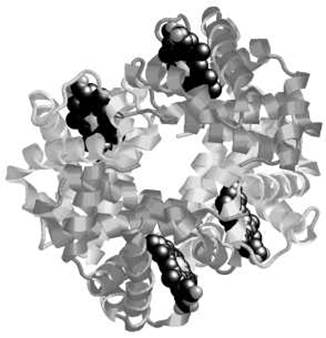
Состоит из четырех субъединиц, двух a (по 141 аминокислотному остатку в каждой) и двух ß (по 146 остатков в каждой). Более темным цветом выделены ß-субъединицы. С каждой субъединицей связана одна молекула гема - выделена черным цветом
ДЕНАТУРАЦИЯ БЕЛКОВ И ПОДДЕРЖАНИЕ ИХ НАТИВНОЙ КОНФОРМАЦИИ В УСЛОВИЯХ КЛЕТКИ
Денатурация белков - это разрушение их нативной конформации, вызванное разрывом слабых связей, стабилизирующих пространственные структуры, при действии денатурирующих агентов.
РЕАГЕНТЫ И УСЛОВИЯ, ВЫЗЫВАЮЩИЕ ДЕНА ТУРАЦИЮ БЕЛКОВ
Денатурирующие агенты |
Особенности действия реагента |
Высокая температура (выше 600 С) |
Разрушение слабых связей в белке |
Кислоты и щелочи |
Изменение ионизации ионогенных групп, разрыв ионных и водородных связей |
Мочевина |
Разрушение внутримолекулярных водородных связей в результате образования водородных связей с мочевиной |
Спирт, фенол, хлорамин |
Разрушение гидрофобных и водородных связей |
Соли тяжелых металлов |
Образование нерастворимых солей белков и ионов тяжелых металлов |