БІОХІМІЯ ДЛЯ ВЧИТЕЛЯ - Ф.Ф. БОЄЧКО - 1985
ОСНОВНІ ХІМІЧНІ КОМПОНЕНТИ КЛІТИН
БІЛКИ — ОСНОВА ЖИТТЄДІЯЛЬНОСТІ ОРГАНІЗМІВ
Серед усіх речовин органічної природи білки займають особливе місце — вони становлять основу структури живих організмів і виконують цілий ряд життєво важливих функцій.
Білкові речовини відомі людині з давніх часів, та лише на початку XVIII ст. було встановлено, що речовини, які, містяться в соках рослин та екстрактах тваринних тканин, мають однакову природу і подібно до яєчного білка зсідаються від нагрівання. Хімію білкових речовин першим почав вивчати італійський дослідник Я. Беккарі. У 1728 р. він виділив з пшеничного борошна білок — клейковину і дослідив окремі його властивості. Пізніше подібні білкові речовини було виділено з різних рослинних і тваринних тканин та рідин. Докладне дослідження елементарного складу цих речовин показало, що вони подібні не лише за зовнішніми ознаками і деякими властивостями, а й за складом.
Вивчав властивості білкових речовин у той період і французький хімік А. Фуркруа. Він грунтовно дослідив білки сироватки крові і назвав три її компоненти — желатин, альбумін і фібрин. Дослідник використав назву «альбумін», щоб вказати на відмінність основного компонента сироватки крові від подібного за властивостями яєчного білка, який також зсідався від нагрівання і набував білого забарвлення. Подібні речовини, які коагулювали внаслідок нагрівання з утворенням білого осаду, були виділені з багатьох об’єктів тваринного і рослинного походження і стали називатись білками.
Пізніше, у 1839 р. голландський хімік Г. Мульдер на основі дослідження основних складових компонентів білкових речовин назвав їх протеїнами (від грецького «ргоtos» — перший, найважливіший). Обидві назви залишились в хімії білків до нашого часу.
В організмі білки є найбільш поширеною та гетерогенною групою органічних речовин, які мають важливе значення, Зокрема, з білками пов’язані найважливіші функції і характерні специфічні особливості живих організмів, такі, як рух, подразливість, здатність до росту і відтворення собі подібних, травлення і виділення продуктів метаболізму, вироблення пристосувальних реакцій до умов зовнішнього середовища, явища спадковості та імунітету, діяльність органів чуттів тощо. У кожній з тисячі реакцій, що відбуваються в клітині, беруть участь білки, які становлять основну масу активної речовини клітини.
Дослідження в галузі біологічних наук підтверджують, що білки відіграють важливу роль у формуванні унікальної структури живих організмів, хоч відтворення живого, явищ спадковості визначається молекулярною структурою і інших біополімерів клітин — нуклеїнових кислот.
Характерні особливості білків як основи життя визначаються в основному структурою та функціями їх молекул. Білки мають цілий ряд особливостей, що виділяють їх серед інших важливих біополімерів, які входять до складу живих систем. Це насамперед висока поліфункціональність і здатність до різних фізичних та хімічних перетворень, різноманітність структури і здатність утворювати надмолекулярні комплекси і структури, наявність каталітичної активності і здатність до міжмолекулярної взаємодії, висока видова специфічність тощо.
Хімічний склад білків
Дослідження хімічної природи білків розпочалося з вивчення їх елементарного складу. У 1810 р. французькі вчені Ж- Гей-Люссак і Л. Тенар провели дослідження елементарного складу білкових речовин і встановили, що вони містять такі основні елементи: вуглець, водень, кисень, азот. Крім того, у складі деяких білків було виявлено також незначну кількість сірки, фосфору та інших елементів.
Пізніше німецький учений Л. Міхаеліс провів дослідження елементарного складу білків сироватки крові, а французький дослідник Ж. Буссенго — аналіз елементарного складу білків рослинного походження. Ці та наступні дослідження показали, що вміст основних елементів у білках рослинного і тваринного походження майже однаковий і становить в середньому: 50—55 % вуглецю, 6,5—7,3 % водню, 15—17 % азоту, 21—23 % кисню та 0,3—2,5 % сірки.
Оскільки в складі різних білків найбільшою стабільністю характеризується вміст азоту — приблизно 16 %, то за його кількістю почали визначати вміст білків у різних продуктах рослинного і тваринного походження (метод К’єль- даля). Для цього добуту кількість азоту (в результаті аналізу певних продуктів) множать на коефіцієнт 6,25, виходячи з того, що вміст азоту в білках становить 16 % (100 : 16= 6,25). Цим методом широко користуються для визначення вмісту білків у різних органах і тканинах рослинних та тваринних організмів, а також у продуктах харчування.
Проте навіть грунтовне вивчення елементарного складу білків ще не давало уяви про будову їх молекул.
Будову білків почали досліджувати в першій половині XIX ст. У процесі цих досліджень увагу вчених привернули амінокислоти, які тривалий час розглядались не як складові частини білкових молекул, а як результат дії на білкові речовини сильних хімічних реагентів.
Першу амінокислоту з білкового гідролізату желатину було виділено в 1820 р. Ця амінокислота солодка на смак, тому дістала назву глікокол (від грецького glykys — солодкий і латинського colla — клей). Вперше думку про амінокислотний склад білків висловив російський хімік М. Любавін.
Застосовуючи метод гідролізу білків, було виділено цілий ряд інших амінокислот. До 1900 р. з білків було виділено більш як 10 різних кислот. Тепер відомо, що до складу білків входить 20 різних амінокислот.
Амінокислоти — основні структурні одиниці білків
У природі існує майже 200 різних амінокислот. Проте до складу більшості білків постійно входить лише 20 амінокислот. 10 амінокислот зустрічається в білках дуже рідко. Усі ці амінокислоти часто називають протеїногенними. Решта амінокислот входить до складу фізіологічно активних речовин (гормонів, коферментів, антибіотиків) або міститься в органах і тканинах тварин і рослин у вільному стані й виконує важливу біологічну функцію.
Природний синтез амінокислот постійно відбувається в рослинних організмах. Частина амінокислот синтезується також в організмі людини і тварин. Ряд амінокислот, що не синтезуються в організмі, зокрема протеїногенних, повинні надходити в організм з продуктами харчування, бо вони не можуть бути замінені іншими амінокислотами. Ці амінокислоти називаються незамінними. До них належать валін, лейцин, ізолейцин, метіонін, треонін, лізин, фенілаланін і триптофан. Вважають також, що частково незамінними є амінокислоти аргінін і гістидин.
Відсутність незамінних амінокислот призводить до порушення цілого ряду біохімічних процесів, насамперед синтезу багатьох біологічно активних речовин. Крім того, для організму досить важливим є співвідношення незамінних
амінокислот у продуктах харчування. Найбільшу біологічну цінність мають білки, у яких оптимальне співвідношення незамінних амінокислот. У цьому випадку потреба організму в білках може задовольнятись мінімальною їх кількістю.
Амінокислоти — це похідні органічних кислот, у молекулі яких один або кілька атомів водню заміщено на аміногрупи. У протеїногенних амінокислотах аміногрупа, як правило, розміщується біля а-вуглецевого атома, тобто всі вони є а-амінокислотами. їх загальну формулу (за винятком проліну і оксипроліну) можна показати так:
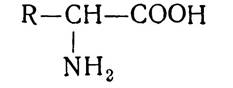
Таблиця 3. Фізичні властивості амінокислот
Амінокислоти |
Відносна молекулярна маса |
Розчинність у 100 г води при- температурі 25°С |
Температура плавлення, °С |
Ізоелектрична точка pH |
|
Повна назва |
Скорочені буквенні позначення |
||||
Аланін |
Ала Ala А |
89,06 |
16,51 |
297 розкл |
6,0 |
Аргінін |
Apr Arg Р |
174,14 |
15,0 |
207 |
10,76 |
Аспарагінова кислота |
Асп Asp Д |
133,06 |
0,50 |
251 |
2,77 |
Валін |
Вал Val V |
117,09 |
8,85 |
315 |
5,96 |
Гістидин |
Гіс His Н |
155,09 |
4,29 |
7,59 |
|
Гліцин |
Глі Gly G |
75,05 |
24,99 |
292 |
5,97 |
Глутамінова кислота |
Глу Glu Е |
147,08 |
0,84 |
248 |
3,22 |
Ізолейцин |
Ілс Ile І |
131,11 |
4,12 |
280 розкл |
6,02 |
Лейцин |
Лей Leu L |
131,11 |
2,19 |
33 |
5,98 |
Лізин |
Ліз Lys К |
146,13 |
Добра |
224 |
9,74 |
Метіонін |
Мет Met М |
149,15 |
3,35 |
283 |
5,74 |
Пролін |
Про Pro Р |
115,08 |
16,23 |
228 |
5,68 |
Серин |
Сер Ser S |
105,06 |
5,02 |
228 |
5,68 |
Тирозин |
Тир Туг У |
181,09 |
0,05 |
310 розкл |
5,66 |
Триптофан |
Три Try W |
204,11 |
1.14 |
298 |
5,89 |
Треонін |
Тре Thr Т |
119,08 |
20,05 |
253 |
5,16 |
Цистеїн |
Цис Cys С |
121,12 |
Дуже добра 3,00 |
258 розкл |
5,07 |
Фенілаланін Аспарагін Глутамін |
Фен Phe Г Асн Asn N Глн Gin Q |
165,09 |
283 розкл 207 |
5,91 5,41 5,65 |
|
Усі амінокислоти побудовані за однаковим принципом і відрізняються одна від одної лише за хімічною природою радикалів. Радикалами можуть бути залишки ациклічних і циклічних вуглеводнів, їх похідні, різні гетероцикли тощо. З білків виділено також амінокислоти, які містять більш як одну амінну або карбоксильну групу. При наявності в складі амінокислоти двох аміногруп одна з них розміщується в a-положенні, а друга — у ω-положенні, тобто біля першого вуглецевого атома з протилежного кінця від α-аміногрупи. З продуктів гідролізу білків виділено амінокислоти, які містять групу NH замість NH2.
Виділені з білків амінокислоти — це безбарвні кристалічні речовини, переважна більшість яких добре розчинна у воді і погано розчинна в органічних розчинниках. Основні фізичні константи амінокислот наведено в табл. 3.
Амінокислоти, як і ряд інших органічних сполук, е оптично активними. Вони мають здатність повертати площину поляризованого променя світла, що проходить крізь їх розчин. Ця властивість характерна для всіх сполук, які містять в складі молекул асиметричний (зв’язаний з чотирма різними атомами, групами атомів або радикалами) атом вуглецю. Кожна амінокислота може існувати в двох оптично активних формах — правообертаючій, яку позначають знаком ( + ) і лівообертаючій, яку позначають знаком (-).
Конфігурацію амінокислот визначають у порівнянні з гліцериновим альдегідом. Як відомо, існує дві форми гліцеринового альдегіду — D-форма і L-форма.
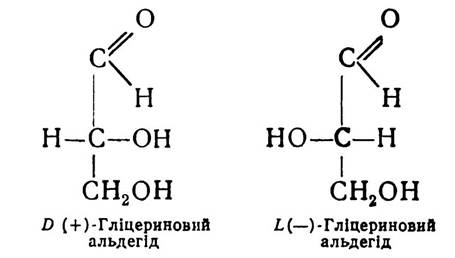
Якщо розміщення атома водню біля вуглецю в а-поло- женні амінокислоти подібне до розміщення водню в тому самому положенні D-гліцеринового альдегіду, то амінокислота належить до D-ряду. А коли розміщення атома водню амінокислоти відповідає L-формі гліцеринового альдегіду, то і амінокислота належить до L-ряду.
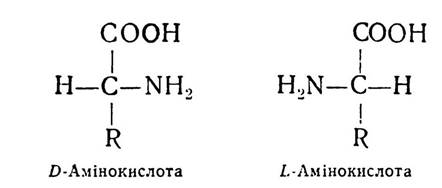
D-форма гліцеринового альдегіду завжди повертає площину поляризованого променя світла вправо (+), L-форма вліво (—). Проте для ряду сполук, у тому числі й амінокислот, позначення «D» і «L» не відповідають напряму повертання площини поляризованого променя і характеризують не оптичну активність амінокислот, а належність їх до групи споріднених сполук, які мають однакову просторову конфігурацію біля а-вуглецевого атома.
Біологічне значення D- і L-амінокислот різне. Зокрема, у білках рослинного і тваринного походження знайдено переважно амінокислоти L-ряду. Одна частина з них є право-, а друга — лівообертаюча, тому біля букв «D» і «L» ставлять знак ( + ) або (-).
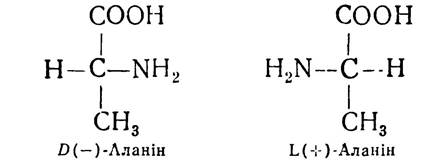
Оптичними антиподами природних амінокислот є амінокислоти D-ряду, які добувають переважно хімічним синтезом. Останнім часом D-форми деяких амінокислот знайдено як у вільному стані, так і в складі окремих антибіотиків і мікроорганізмів. У жуйних тварин джерелом амінокислот є білки мікроорганізмів рубця. Частина цих амінокислот належить до D-ряду і не може використовуватись для побудови молекул тваринних білків. Крім того, у деяких органах вищих хребетних тварин виявлено фермент оксидазу D-амінокислот, значно активніший, ніж оксидаза а-амінокислот L-ряду. Цей фермент каталізує окислювальне дезамінування амінокислот. D- і L-амінокислоти відрізняються одна від одної і за смаком. Так, амінокислоти D-ряду солодкі, а амінокислоти L-ряду гіркі або зовсім не мають смаку. По-різному ці дві форми амінокислот поводяться і в організмі людини і тварин, оскільки ферментні системи організму специфічно пристосовані до засвоєння амінокислот L-ряду.
За певних умов може змінюватись конфігурація груп Н i NH2 біля асиметричного а-вуглецевого атома амінокислот, внаслідок чого частина L-амінокислот перетворюється в D-форму. Цей процес називається р а це м а цією, а суміші амінокислот D- і L-рядів — рацемічними. Спеціальними методами з цих сумішей можна виділити один з оптичних ізомерів у чистому вигляді. Процес рацемації амінокислот частково має місце і в кишечнику вищих тварин і людини. Зокрема, є дані, що частина амінокислот L-ряду під впливом ферментів рацемаз частково перетворюється в D-амінокислоти. Такий шлях перетворення доведено поки що для аланіну і глутамінової кислоти.
Амінокислоти — аморфні сполуки, які містять дві протилежні за властивостями функціональні групи — карбоксильну, яка надає їм кислотних властивостей, і аміногрупу, яка обумовлює лужні властивості амінокислот. У водних розчинах або в кристалічному стані у звичайних умовах карбоксильна і аміногрупа амінокислот можуть взаємодіяти між собою: іон водню відщеплюється від карбоксильної групи амінокислоти і приєднується за місцем неподільної електронної пари азоту:
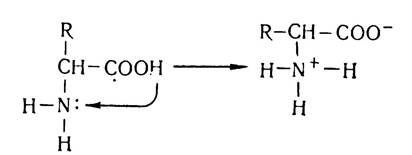
Таким чином, молекула амінокислоти перетворюється в диполярний іон (цвігтер-іон). В результаті цієї внутрімолеку- лярної взаємодії утворюється нейтральна сполука — внутрішня сіль амінокислоти, тому розчини амінокислот в більшості випадків нейтральні і не діють на індикатори (за винятком амінокислот, які містять у складі молекул кілька аміно- чи карбоксильних груп).
У розчинах амінокислоти поводяться як амфотерні електроліти (амфоліти): залежно від pH середовища вони можуть проявляти кислотні або лужні властивості. Так, у кислому середовищі завдяки надлишку іонів Н+ пригнічується дисоціація корбоксильної групи і амінокислота при цьому набуває позитивного заряду і поводиться як катіон:

У лужному середовищі від групи NH3 відщеплюється іон водню, внаслідок чого вона руйнується і амінокислота набуває негативного заряду, тобто поводиться як аніон:
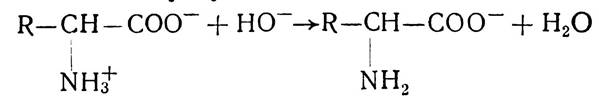
Значення pH середовища, при якому загальний сумарний заряд амінокислоти дорівнює нулю, називається ізоелектричною точкою. У цьому випадку молекула амінокислоти електронейтральна і не може рухатися в електричному полі ні до анода, ні до катода.
Слід зазначити, що ізоелектрична точка для різних амінокислот залежить від наявності в їх складі здатних до іонізації аміно- і карбоксильних груп (табл. 3).
Ступінь іонізації карбоксильних груп дещо вищий, ніж аміногруп. Тому ізоелектрична точка моноамінокарбонових кислот перебуває в межах значення pH 6,0. Водні розчини цих амінокислот, крім диполярних іонів, містять невелику кількість аніонів та іонів водню (Н+).
Наявність у складі молекул амінокислот аміно- і карбоксильних груп зумовлює їх участь у хімічних реакціях, властивих для цих груп. Вони можуть утворювати похідні, характерні для амінів і карбонових кислот. Подібно до інших карбонових кислот, амінокислоти утворюють солі, аміди, галогенангідриди та ефіри.
Так, амінокислоти з лугами утворюють солі:
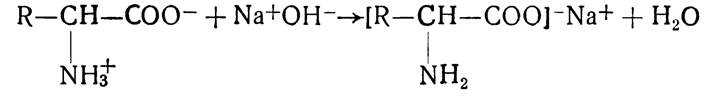
Зі спиртами вони утворюють складні ефіри:

Ця реакція використовується для розділення амінокислот фракційною перегонкою їх ефірів у вакуумі.
Амінокислоти можуть взаємодіяти з азотистою кислотою. При цьому утворюється оксикислота і виділяється вільний азот:
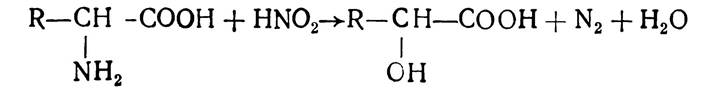
Ця реакція лежить в основі методу кількісного визначення амінокислот за Ван-Слайком.
Амінокислоти вступають у реакцію взаємодії з формальдегідом:

Ця реакція лежить в основі методу формільного титрування, що застосовується для кількісного визначення амінокислот за Зеренсеном.
Досить характерною для аміногрупи є нінгідринова реакція. Нею користуються для кількісного визначення малих концентрацій амінокислот. Ця реакція характерна для всіх амінокислот і пептидів, які мають вільну аміногрупу.
З неорганічними кислотами амінокислоти реагують як основи і утворюють солі:

Завдяки наявності в молекулах амінокислот різних функціональних груп вони можуть вступати у взаємодію між собою з утворенням а) пептидів і б) дикетопиперазинів:

Амінокислоти часто класифікують за будовою вуглецевого ланцюга і за кількістю амінних і карбоксильних груп (див. форзац І).
Використовується і класифікація амінокислот, яка грунтується на полярності їх радикалів. За цією ознакою амінокислоти поділяють на чотири класи: з неполярними радикалами, з незарядженими полярними радикалами, з негативно зарядженими полярними радикалами та з позитивно зарядженими полярними радикалами.
Дослідження амінокислотного складу різних органів і тканин рослинних і тваринних організмів показали, що вільних амінокислот у природі дуже мало. Добувають амінокислоти гідролізом білків, а також хімічним і мікробіологічним синтезом.
Розрізняють три види гідролізу білків — кислотний, лужний і ферментативний. У лабораторних і заводських умовах здебільшого використовують кислотний гідроліз. Внаслідок гідролізу утворюється суміш амінокислот, які входили до складу білка. Окремі амінокислоти з гідролізату виділяють специфічними реагентами осадженням, утворенням ефірів амінокислот або розгонкою на спеціальних смолах, а також методом електрофорезу і хроматографії. Проте гідролізом добувають не всі амінокислоти, а головним чином ті, що входять до складу білків у відносно великих кількостях.
З гідролізатів амінокислоти виділяють у вигляді важкорозчинних солей чи інших сполук. Таким способом виділяють гліцин з желатину, глутамінову кислоту з казеїну та клейковини злаків, тирозин з фіброїну шовку, цистин і цистеїн з шерсті, гістидин з білків крові тощо.
Для добування цілого ряду амінокислот широко застосовують синтетичні методи. Серед них метод амінування α-галогенокарбонових кислот, ціангідрильний метод. Амінокислоти добувають алкілуванням аміномалонового ефіру, синтезами з участю метилового ефіру нітрооцтової кислоти.
Крім того, нині розроблено методи хімічного синтезу деяких амінокислот. Зокрема, синтез метіоніну з метилмер-каптану і акрилового альдегіду, синтез триптофану з Здольного альдегіду і нітрооцтового ефіру, синтез глутамінової кислоти з акрилонітрилу, синтез лізину з циклогексану або з 1-нітро-1,3-бутадієну і нітрооцтового ефіру та ін. Застосування різноманітних хімічних методів дало можливість синтезувати майже всі амінокислоти. Синтез метіоніну і глутамінової кислоти широко застосовується в промислових' умовах. В деяких науково-дослідних установах ведуться роботи щодо промислового виробництва ще цілого ряду амінокислот.
З кожним роком дедалі ширше застосовується мікробіологічний синтез амінокислот, який грунтується на здатності окремих видів мікроорганізмів синтезувати певну амінокислоту з простих речовин — азоту і вуглецю та виділяти її в навколишнє середовище. Нині розпочато промислове виробництво мікробіологічним способом таких амінокислот, як лізин, глутамінова кислота, триптофан.
Іноді поєднують хімічні методи синтезу з мікробіологічними. При хімічному синтезі утворюються здебільшого рацемічні суміші, з яких потім з участю мікроорганізмів виділяють певний ізомер.
Високі темпи розвитку промислового виробництва амінокислот зумовлені насамперед широким використанням їх у тваринництві. Амінокислотний склад кормів відіграє важливу роль у забезпеченні повноцінного, збалансованого раціону сільськогосподарських тварин.
Збалансування раціонів тварин за найбільш важливими амінокислотами — метіоніном, лізином, триптофаном — дає можливість знизити витрати кормового протеїну на 20— 25 % і на стільки ж підвищити процент використання азотистих речовин корму і продуктивність тварин.
Амінокислоти широко використовують також у медицині. Зокрема, суміші амінокислот і продукти гідролізу білків потрібні для парентерального (позашлунково-кишкового) харчування. Деякі амінокислоти є засобом лікування та профілактики цілого ряду захворювань. Метіонін, наприклад, використовують при захворюваннях печінки, недокрів’ї, опіках. Гістидин — при виразковій хворобі шлунка, триптофан — при подагрі, глутамінову кислоту — при захворюваннях нервової системи. Амінокислоти займають центральне місце в азотистому обміні, вони є джерелом утворення багатьох біологічно активних речовин, які відіграють важливу роль в обмінних процесах організмів.
Будова білків
Серед багатьох проблем біохімії важливою і надзвичайно складною є проблема вивчення будови природних біополімерів — білків. Вона охоплює такі важливі питання:
1. Вивчення кількісного і якісного амінокислотного складу молекул білків. 2. Вивчення видів зв’язків у білковій молекулі. 3. Вивчення послідовності розміщення амінокислот у молекулі білків. 4. Дослідження конформації білкових молекул тощо.
Над розв’язанням цих проблем протягом тривалого часу працювали вчені багатьох країн світу. Було висунуто багато припущень і гіпотез відносно структури і складових компонентів білкової молекули. З’ясувати питання будови білка спочатку намагались на основі дослідження продуктів ферментативного розпаду його — пептонів, які певний час вважались основними компонентами структури білкових молекул.
Наприкінці XIX ст. російський учений О. Я. Данилевський висунув гіпотезу про те, що основними компонентами білкових молекул слід вважати амінокислоти. Досліджуючи продукти розпаду білкових молекул, він помітив, що після добавляння сульфату міді (II) до продуктів неповного лужного гідролізу білків останні набувають синьо-фіолетового забарвлення. Таке саме забарвлення спостерігалось і тоді, коли до розчину біурету добавляли сульфат міді (II). Розчин біурету утворюється внаслідок відщеплення молекули аміаку від двох молекул сечовини:
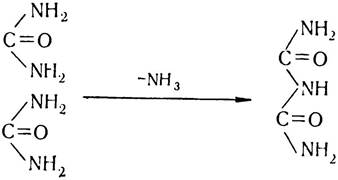
Оскільки О. Я. Данилевський вважав, що біуретова реакція зумовлена чергуванням структур (груп)— СО—NH — у молекулі біуретового комплексу, він висловив припущення, що. саме цей комплекс і є основою будови для всіх білків.
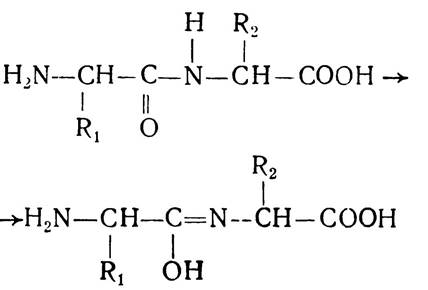
Отже, Данилевський перший вказав на наявність у білках зв’язку між α-карбоксо- і α-аміногрупою, який пізніше було названо пептидним. Тому Данилевського вважають першовідкривачем пептидного зв’язку, хоч у його працях ще немає чіткого визначення полімерної будови білкових молекул.
Дальші дослідження структури білкових молекул проводив німецький учений А. Коссель. Він висунув гіпотезу так званих протеїнових ядер. Його співвітчизники Е. Фішер, Е. Абдергальден і В. Гофмейстер докладно вивчали продукти повного гідролізу білкових молекул, їх якісний і кількісний склад та співвідношення амінокислот у гідролізатах. На основі експериментальних досліджень Е. Фішер підтвердив ідею Данилевського про наявність у білках зв’язку кетоімідного виду між α-карбоксо- і α-аміногрупою сусідніх кислот внаслідок відщеплення води. Це твердження грунтувалось на тому, що, по-перше, при гідролізі білків основними продуктами розпаду є амінокислоти, по-друге, нативні, білки містять невелику кількість аміногруп, тоді як продукти лужного, кислотного чи ферментативного гідролізу містять їх у великій кількості. Крім того, за рахунок даного зв’язку можна утворити велику кількість продуктів конденсації амінокислот.
Структури, що виникають в результаті утворення пептидних зв’язків між залишками амінокислот, було названо пептидами. Залежно від кількості амінокислотних залишків, які беруть участь у реакції поліконденсації, утворені сполуки мають назву ди- три- тетра- або поліпептидів. Назва пептиду утворюється з назв залишків амінокислот, які входять до його складу, починаючи з (N)-кінцевої амінокислоти, причому в назві амінокислот, карбоксильні групи яких беруть участь у реакції конденсації і руйнуються з утворенням ацильних залишків, суфікс «н» змінюється на «л». Наприклад, трипептид, що утворюється внаслідок конденсації амінокислот аланіну, валіну і метіоніну має назву аланіл-валіл-метіонін. У структурних формулах пептидів аміногрупу завжди записують зліва, а карбоксильну групу — справа. Будову наведеного трипептиду можна записати так:
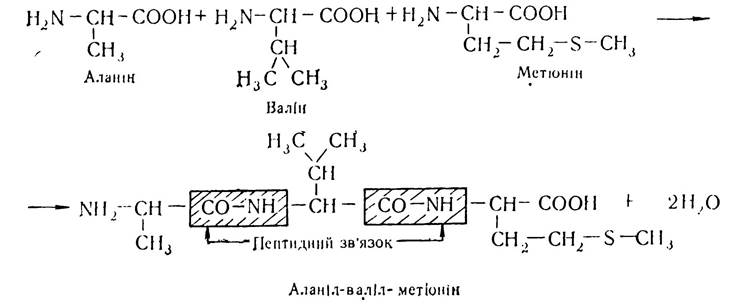
Утворений трипептид має вільні карбоксильну і аміногрупу і може знову конденсуватись з іншими залишками амінокислот, утворюючи поліпептиди. Велика кількість пептидів утворюється в організмі людини і тварин в результаті різноманітних метаболічних процесів. Багато з них має високу біологічну активність і бере участь у процесах проміжного обміну.
Завдяки наполегливій праці учених було розв’язано складну і важливу проблему хімії білка — з’ясовано характер зв’язку амінокислот у молекулі білка, створено пептид- ну теорію, яка не втратила свого значення і тепер. Саме завдяки з’ясуванню характеру зв’язку амінокислот у білковій молекулі стало можливим встановлення деталей будови окремих білків та вивчення конформації білкових молекул.
Дослідження міжатомних відстаней у пептидних зв’язках —СО—NH—, які становлять основу поліпептидного ланцюга, а також валентних кутів між атомами водню, кисню, азоту і вуглецю допомогло виявити ряд особливостей будови поліпептидного ланцюга та пептидного зв’язку. Зокрема, було встановлено, що в поліпептидному ланцюгу атоми вуглецю і азоту розміщуються приблизно в одній площині, а атоми водню і радикали — під кутом 109°29' до неї.
Особливістю будови поліпептидного ланцюга є те, що основний ланцюг, побудований з фрагментів (—NH—СН—СО—), оточений різноманітними радикалами, що містять в своєму складі фенільні, тіолові, амідні, гідроксильні та інші функціональні групи, які мають високу реакційну здатність.
Здатність деяких функціональних груп до іонізації зумовлює те, що білкова молекула залежно від кількісного їх співвідношення набуває відповідно сумарного позитивного або негативного заряду, а також певного значення pH у водному розчині. Функціональні групи визначають також ряд інших характерних особливостей білкових макромолекул — просторову конфігурацію поліпептидного ланцюга, біологічну активність, характер хімічної взаємодії біополі- меру та ін.
Дослідження структури пептидного зв’язку за допомогою рентгено-структурного аналізу показало, що внаслідок зв’язаності р-електронів атомів вуглецю і кисню карбонільної групи з вільними електронами атома азоту імінної групи виникає перерозподіл електронної густини:
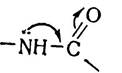
В результаті зменшується довжина зв’язку між атомами азоту і вуглецю з 1,47 нм до 1,32 нм. Таким чином, пептид- ний зв’язок займає проміжне місце між простим (ординарним) зв’язком, довжина якого 1,47 нм, і подвійним, відстань в якому між атомами С—N становить 1,25 нм. Для пояснення цього було висловлено припущення про існування мезо- мерії двох структур — нейтральної і полярної:
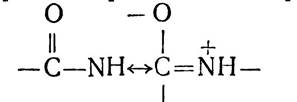
Одночасно було виявлено деяке подовження зв’язку між атомами вуглецю і кисню від 1,21 до 1,24 нм, внаслідок чого він стає частково ординарним. Мезомерія, або резонанс,— фактор, який підвищує стійкість хімічних сполук, і саме ним пояснюється міцність пептидного зв’язку. Явище мезомерії зумовлює також планарність амідного зв’язку в пептидах (всі чотири атоми амідного зв’язку розміщені в одній площині) і стабільність та жорсткість його.
При вивченні величини кутів і взаємної орієнтації атомів пептидної групи було встановлено, що речовини, які містять амідні групи, за винятком деяких циклічних сполук, мають плоску амідну групу в транс-конфігурації, яка стабільніша за цис-конфігурацію.
Характерним для транс-конфігурації є те, що чотири атоми пептидного зв’язку і два α-вуглецевих атоми містяться в одній площині, а кисень карбонільної групи і водень іміногрупи перебувають в транс-положенні один відносно одного (мал. 5).
У зв’язку з тим, що пептидний зв’язок стабільний і жорсткий, вільне обертання навколо нього загальмоване або фактично відсутнє. Остов поліпептидного ланцюга можна уявити собі у вигляді стабільно фіксованих площин, розділених СН—R-групами, відносно яких обертання не загальмоване.
Явище резонансу значною мірою визначає реакційну здатність білків і пептидів. Пептидні зв’язки піддаються таутомерним перегрупуванням з утворенням енольної форми пептидного зв’язку, яка характеризується високою реакційною здатністю.
Експериментальні дані повністю підтвердили поліпептид- ну теорію будови білкових молекул. Методи рентгено-структурного аналізу, інфрачервоної та ультрафіолетової спектроскопії дають змогу розглянути поліпептидний ланцюг з певним чергуванням амінокислотних залишків. Підтвердженням поліпептидної теорії і незаперечним доказом того, що мономерні ланки в білковій молекулі сполучені пептидними зв’язками, є успіхи, досягнуті в синтезі білків і пептидів — інсуліну, рибонуклеази, окситоцину, вазопресину і цілого ряду інших, які мають біологічну активність нативних білків.

Мал. 5. Пептидні зв’язки і кути між ними.
Атоми, що показані на заштрихованому полі, лежать в одній площині.
Синтез пептидів. Природні пептиди
Синтез пептидів — досить складний і трудомісткий процес. Він охоплює ряд послідовних стадій: блокування всіх груп, які не повинні брати участь у реакції, синтез поліпептидного ланцюга, видалення блокуючих реагентів та ін.
Синтезом пептидів займалась велика група учених, починаючи з кінця XIX ст. Однак лише в 1907 р. німецькому хіміку Е. Фішеру і його учню Е. Абдергальдену за допомогою оптично активних галоїдацил-галоїдангідридів вдалося синтезувати пептиди, до складу яких входили амінокислоти D- і L-ряду. У цей час Е. Фішер синтезував знаменитий октадекапептид: L-лєйцил-(тригліцил)-L-лейцил-(тригліцил)-L-лейцил- (октагліцил) -гліцин. Синтез даного поліпептиду на той час був важливим досягненням і протягом тривалого часу вважався неперевершеним. Лише в 1916 р. Абдергальден здійснив синтез поліпептиду, який мав на один амінокислотний залишок більше — нонадекапептид.
Е. Фішер розробив ряд методів, які давали змогу добувати поліпептиди з будь-якою послідовністю чергування залишків а-амінокислот. Найчастіше застосовувався метод послідовної конденсації хлорангідридів α-галогенокарбонових кислот з а-амінокислотами:
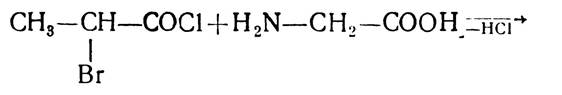
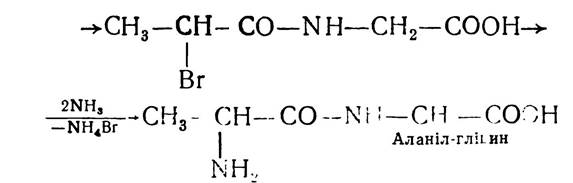
Цей метод, з деякими уточненнями, і зараз застосовують для синтезу пептидів. І-амінокислоти використовують як ефіри, бо карбоксильна група амінокислот блокована і у взаємодію вступає α-аміногрупа:
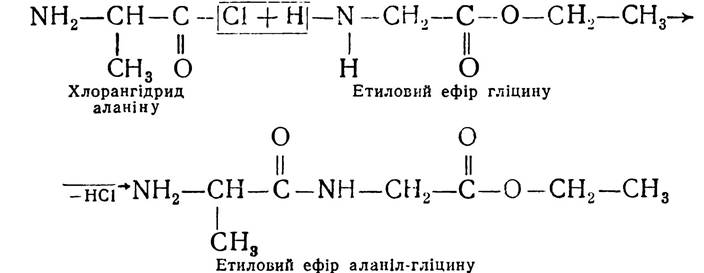
Потім омиленням ефіру, що утворився, добувають вільний дипептид.
З інших методів добування поліпептидів заслуговує на увагу метод взаємодії ацилфосфатів амінокислот та метод конденсації карбоксилангідридів у водних розчинах. Карбоксилангідриди утворюються внаслідок дії на амінокислоту фосгену за реакцією:

Потім карбоксилангідриди конденсуються з утворенням поліпептидів:

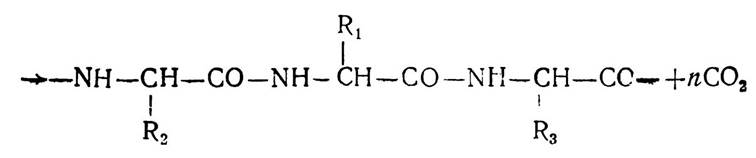
Цим методом добувають на основі синтезу цілий ряд біологічно активних поліпептидів — інсулін, адренокортико- тропний гормон (АКТГ) та ін.
Всього Е. Фішер і його учні синтезували більш як 125 пептидів, різних за складом і відносною молекулярною масою. На основі порівняння властивостей синтезованих пептидів з продуктами повного гідролізу білкових молекул — пептонами Е. Фішер прийшов до висновку, що із збільшенням довжини ланцюгів подібність між ними збільшується. Поліпептиди, як і пептони, давали біуретову реакцію, були гіркі на смак і, що найважливіше, розщеплювалися протеолітичними ферментами, хоч за деякими параметрами все-таки відрізнялися від нативних білків. Це свідчило про те, що хоч білки й побудовані з великої кількості залишків амінокислот, зв’язаних між собою пептидними зв’язками, але вони мають значно складнішу будову і специфічні особливості порівняно з поліпептидами, які добуті хімічним синтезом.
Значних успіхів у галузі синтезу пептидів досягнуто в другій половині XX ст., коли було добуто на основі синтезу гормони пептидної природи, які характеризувались біологічною активністю. У цей час було синтезовано окситоцин і вазопресин, згодом — брадікінін, АКТГ та інші пептиди. Тріумфом у галузі синтезу поліпептидів був синтез гормону підшлункової залози — інсуліну та синтез в 1968 р. рибонуклеази.
Синтез цих біологічно активних речовин потребував напруженої праці цілих колективів учених протягом кількох десятиріч. Наприклад, у процесі синтезу інсуліну, до складу якого входить 51 амінокислотний залишок, було проведено 5000 хімічних реакцій, а для синтезу рибонуклеази — 11000.
Синтез поліпептидів значно спростився після того, як у 1968 р. було сконструйовано автоматичний прилад з програмним управлінням — синтезатор, який давав змогу проводити автоматичний твердофазний синтез поліпептидних ланцюгів за порівняно короткий час. Синтез поліпептиду, який містить у своєму складі 60—65 елементарних ланок, здійснюється за кілька днів, а синтез нонапептиду брадікініну — за 27 год. Синтез гормону інсуліну було проведено за 10 днів. Цим методом здійснили синтез поліпептидного ланцюга рибонуклеази великої рогатої худоби, який складається з 124 амінокислотних залишків. Суть методу полягає в тому, що перша амінокислота фіксується своєю карбоксильною групою на спеціально обробленій смолі, яка сполучається з амінокислотою з утворенням ковалентних зв’язків. Фіксована амінокислота в присутності конденсуючого агента — дициклогексилкарбодііміду ацилюється наступною амінокислотою, в якій блокована аміногрупа. Таким чином утворюється приєднаний до смоли, захищений дипептид, зв’язаний із смолою ковалентним зв’язком через кінцеву карбоксильну групу. На другому етапі після підкислення середовища видаляють блокуючий агент, який розпадається на оксид вуглецю (IV) та ізобутилен, а потім ацилюється дипептид наступною амінокислотою. Після закінчення процесу поліконденсації поліпептид звільняється з комплексу смола — пептид і очищається від сторонніх домішок.
Нині хімічним синтезом добуто велику кількість пептидів, багато їх виділено також з природних джерел — близько 120, але функції багатьох з них з’ясовано ще не повністю.
Багато низькомолекулярних пептидів є компонентами організму людини і тварин і беруть участь у процесах проміжного обміну завдяки своїй біологічній активності. Зокрема, у рослинних і тваринних тканинах досить поширеним є трипептид-глутатіон (γ-глутамілцистеїлгліцин):

Цей трипептид відіграє важливу роль у реакціях оксидо- редукції, що зумовлено його здатністю переходити з окисленої форми (ГS—SГ) у відновлену (ГSH) і навпаки. Глутатіон входить до складу активних центрів ферментів, крім того, відновлена форма глутатіону є коферментом деяких ферментів, що каталізують реакції ізомеризації різних сполук.
У м’язах тварин і людини міститься карнозин (β-аланілгістидин) і ансерин (β-аланіл-1-метилгістидин), які мають велике значення для метаболічних процесів. Радянський учений В. С. Гулевич довів, що при захворюваннях, які пов’язані з дистрофічними процесами в м’язовій тканині, вміст карнозину значно зменшується.

Карнозин бере участь у прискоренні процесів розпаду вуглеводів у м’язах і у вигляді фосфату включається в енергетичний обмін у м’язовій тканині. Ансерйн зустрічається в м’язах птахів і риб. Найбільше його в скелетних м’язах, особливо в тих, які характеризуються високою частотою скорочень. Є дані, які свідчать, що від наявності в м’язах ансерину і карнозину залежить працездатність м’язів.
Важливе значення мають також гормони пептидної при-" роди, зокрема гормони задньої частки гіпофізу — окситоцин і вазопресин, які побудовані з дев’яти залишків амінокислот. Перший сприяє скороченню м’язових волокон навколо альвеол молочних залоз та скороченню гладенької мускулатури матки. Вазопресин підвищує кров’яний тиск і сприяє зменшенню діурезу.
В організмі людини і тварини є фізіологічно активні пептиди: брадікінін, колідин, ангіотензин та ін., які утворюються з біологічно неактивних білків плазми. Усі вони фізіологічно активні — колідин і брадікінін стимулюють м’язові скорочення, ангіотензин дає судинозвужуючий ефект. До поліпептидів належить також цілий ряд антибіотиків — граміцидин, мікобацилін та ін., що є циклопептидами і широко застосовуються в медицині.
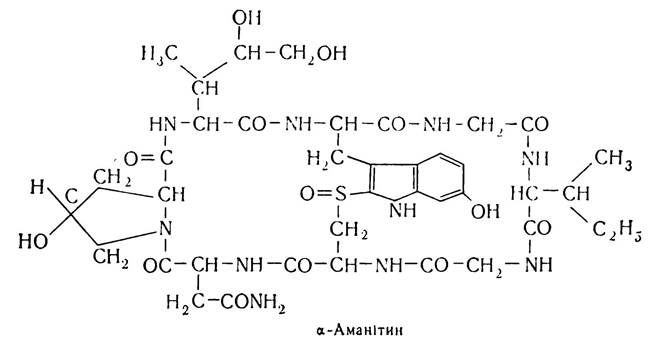
З рослинних циклопептидів слід згадати α-аманітин, виділений з гриба блідої поганки, він високотоксичний. Структура його така:
Види зв’язків у білковій молекулі. У результаті досліджень було встановлено, що, крім пептидного зв’язку, в молекулах білків існують водневий, дисульфідний, іонний, гідрофобний зв’язки.
Водневий зв’язок виникає між ковалентно зв’язаними атомами водню, які мають деякий позитивний заряд, і негативно зарядженими, ковалентно зв’язаними іншими атомами.
У молекулах білків водневий зв’язок найчастіше утворюється атомом водню іміногрупи (NH) одного пептидного зв’язку та електронегативним атомом кисню карбонільної групи (СО) другого пептидного зв’язку. Наявність даного зв’язку зумовлюється тим, що мезомерна форма пептидного зв’язку має надлишок електронів біля атома кисню і нестачу їх біля атома азоту, що призводить до посилення електронегативності карбонільної групи та електропозитивності іміногрупи. В зв’язку з цим створюється своєрідна конкуренція за водневий атом між атомом кисню одного пептидного зв’язку і атомом азоту іншого пептидного зв’язку.
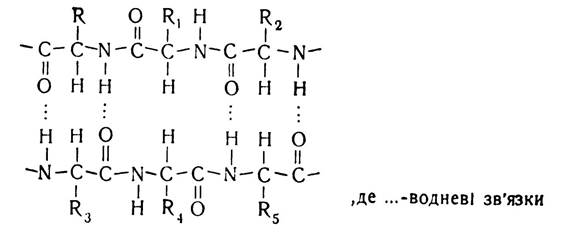
Водневий зв’язок, на відміну від інших зв’язків, досить слабкий. Енергія його утворення дорівнює близько 6,0 кДж, тоді як енергія зв’язку між атомами вуглецю становить приблизно 250 кДж. Саме тому водневий зв’язок легко утворюється і легко руйнується в звичайних умовах. Однак, незважаючи на це, велика кількість цих зв’язків у білковій молекулі створює досить міцні структури, що має особливо велике значення для утворення конформації білкової молекули.
Водневий зв’язок може бути внутріланцюговим, у цьому випадку він з’єднує окремі витки однієї спіралі, і між- ланцюговим — з’єднує різні поліпептидні ланцюги. У натив- них білках цей вид зв’язку може виникати не тільки між, воднем і киснем пептидних угруповань, а й між боковими функціональними групами поліпептидного ланцюга, такими, як залишки тирозину, серину, треоніну, аспарагінової і глутамінової кислот.
Дисульфідний зв’язок — це досить міцний ковалентний зв’язок, який утворюється між залишками амінокислот цистеїну, що входять до складу поліпептидного ланцюга, внаслідок відщеплення двох атомів водню. Цей вид зв’язку може зв’язувати залишки цистеїну в одному полі- пептидному ланцюгу, утворюючи дисульфідні містки, або, з’єднуючи залишки цистеїну різних поліпептидних ланцюгів, стабілізувати специфічне укладання їх при формуванні третинної структури.
Стійкість значної кількості білків зумовлена наявністю в їх структурі дисульфідних зв’язків. Зокрема, велику кількість їх містять білки, які входять до складу сполучної і покривної тканини та ряд білків, які мають високу біологічну активність. Це, зокрема, колаген, еластин, рибонуклеаза, інсулін та ін,
У місцях локалізації дисульфідних зв’язків виникає напруження, яке здатне частково порушувати водневі зв’язки і сприяє дестабілізації спіральних структур, внаслідок чого в поліпептидних ланцюгах, крім спіралізованих, існують також лінійні, неспіралізовані ділянки. Дисульфідні зв’язки забезпечують біологічну активність ряду білків, тому при руйнуванні їх білок втрачає біологічну активність. Зокрема, досить важливу роль відіграють дисульфідні зв’язки в забезпеченні біологічної активності та стабілізації структури в молекулі білка інсуліну.
Молекула лізоциму містить дисульфідні зв’язки, які зв’язують різні ділянки поліпептидного ланцюга, внаслідок чого вона набуває характерної просторової конфігурації, яка забезпечує біологічну активність даного біополімеру.
Іонний зв’язок виникає в молекулах білків при наявності в їх складі залишків амінокислот, здатних до іонізації — аспарагінової і глутамінової кислот, лізину, аргініну та ін.
Як відомо, у водних розчинах білки перебувають у вигляді біполярних іонів, цвіттер-іонів, в яких карбоксильна група має негативний, а аміногрупа — позитивний заряд.
Внаслідок цього між карбоксильними групами  і аміногрупами (NH2) при їх наближенні виникають сили електростатичної взаємодії, які приводять до утворення сольових містків:
і аміногрупами (NH2) при їх наближенні виникають сили електростатичної взаємодії, які приводять до утворення сольових містків:
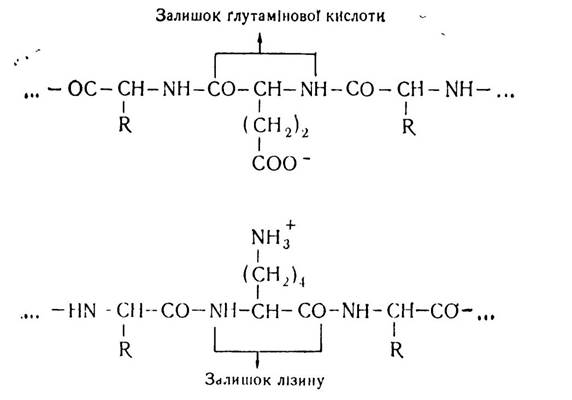
Іонний зв’язок може утворюватись між окремими ланками поліпептидного ланцюга або між полярними групами різних поліпептидних ланцюгів. Хоч до складу нативних білків входить велика кількість амінокислот з полярними радикалами, в утворенні іонних зв’язків бере участь незначна їх кількість. Це зумовлено тим, що частина полярних груп зв’язується з розчинником, оскільки білкова молекула намагається набути такої конфігурації, при якій максимальна кількість полярних груп розміщується на її поверхні.
Гідрофобний зв’язок виникає внаслідок сил Ван дер Ваальса між залишками неполярних радикалів таких амінокислот, як аланін, валін, лейцин, ізолейцин, фенілаланін, триптофан та ін. Схематично гідрофобний зв’язок можна показати так:

Утворення неполярних (гідрофобних) зв’язків зумовлено тенденцією неполярних молекул до асоціації в водних розчинах. При наближенні неполярних залишків амінокислот виникає гідрофобна взаємодія, яка супроводжується певною орієнтацією молекул води, що оточують неполярні групи. Усе це обмежує поступальний рух молекул води і веде до зменшення ентропії. Молекули води ніби виштовхуються з тих ділянок, де виникає гідрофобна взаємодія, а білкова молекула при цьому набуває такої конфігурації, при якій гідрофобні групи переміщуються у внутрішні ділянки молекули, а на поверхні залишаються гідрофільні групи. За цих умов система радикал — вода переходить у стійкішу систему радикал — радикал.
Гідрофобна внутрішня частина білкової молекули, виштовхуючи воду, залишається «сухою», безводною. Це явище допомагає білкам виконувати їх специфічні функції. Зокрема, у гемоглобіні атом заліза розміщується всередині молекули білка. Захищений таким чином від води, він має здатність зв’язуватись з гемоглобіном. Гідрофобний зв’язок найслабший з усіх нековалентних зв’язків, проте, завдяки великій кооперативності гідрофобної взаємодії виникають досить стійкі утворення. Цей вид зв’язку має важливе значення для утворення і стабілізації третинної і, можливо, четвертинної структур білка.
Сучасні уявлення про структурну організацію білків
Вивчення кількісного і якісного амінокислотного складу білків, зв’язків амінокислот в їх молекулах ще не дає повного уявлення про будову білків. Дуже важливо з’ясувати
послідовність розміщення амінокислотних залишків у поліпептидному ланцюгу та просторову конфігурацію білкової молекули.
За сучасними даними в білках розрізняють чотири рівні структури — первинну, вторинну, третинну і четвертинну.
Первинна структура білків. Під первинною структурою білків розуміють порядок розміщення амінокислотних залишків, зв’язаних між собою пептидним зв’язком у поліпептидному ланцюгу. Кожний пептидний ланцюг молекули білка, як і будь-який пептид, має дві кінцеві амінокислоти:
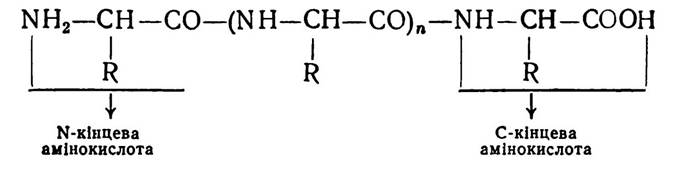
Залишки амінокислот в поліпептидних ланцюгах починають називати з N-кінця і закінчують С-кінцем.
Оскільки до складу білкових молекул входить велика кількість амінокислотних залишків, вивчення їх первинної структури має певні труднощі. Проте за останнє десятиріччя темпи досліджень значно зросли. Це зумовлено насамперед удосконаленням методів вилучення індивідуальних високо чистих білкових препаратів, а також розробкою і широким використанням точних аналітичних методів дослідження. Окремі етапи аналітичних досліджень первинної структури білків автоматизовано.
Молекули білків можуть складатись з одного, двох, чотирьох і більшої кількості поліпептидних ланцюгів.
Поліпептидні ланцюги в молекулі білка можуть бути зв’язані між собою ковалентним зв’язком, зокрема дисульфідними містками (S—S), які утворюються між двома залишками амінокислоти цистеїну. Разом з цим дисульфід- ний зв’язок може виникати і між двома залишками цистеїну, які містяться в одному й тому самому поліпептидному ланцюгу.
Разом з дисульфідними зв’язками між поліпептидними ланцюгами, а також між окремими ділянками одного й того самого поліпептидного ланцюга можуть виникати інші, нековалентні зв’язки (іонні, водневі і гідрофобні). Вони мають важливе значення для стабілізації наступних структур білка.
Кількість поліпептидних ланцюгів у молекулі білка визначають за кількістю N-кінцевих амінокислот, яка припадає на одну молекулу білка. Для цього використовують динітрофенільний метод, або метод Сенгера. Цей метод вперше розробив англійський біохімік Сенгер. Застосовувався він для вивчення первинної структури білка інсуліну. Суть методу полягає в тому, що на білок в слабколужному середовищі діють 2,4-динітрофторбензолом, який сполучається з N-кінцевою амінокислотою пептидного ланцюга. При цьому утворюється динітрофенільне похідне: ДНФ — похідне білка (пептиду).

На наступному етапі динітрофенільне похідне білка (пептиду) піддають кислотному гідролізу (6 н НСL) і всі пептидні зв’язки розриваються, за винятком утвореного 2,4-динітрофенільною групою і α-аміногрупою N-кінцевої амінокислоти. За цих умов утворюються вільні амінокислоти і динітрофенільне похідне N-кінцевої амінокислоти:
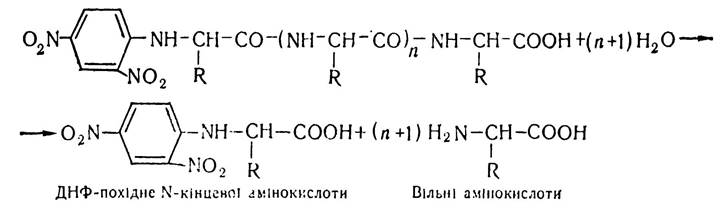
Потім за допомогою певних методів (хроматографії, електрофорезу, колориметрії, спектрофотометрії) проводять якісний і кількісний аналіз N-кінцевих амінокислот. Отже, за кількістю N-кінцевих амінокислот визначають і кількість поліпептидних ланцюгів у молекулі білка.
Для визначення N-кінцевих амінокислот використовуються і інші методи, зокрема дансильний і фенілтіогідантоїновий.
Крім хімічних методів, для визначення N-кінцевих залишків амінокислот застосовують і ферментативні методи.
Якщо білок побудований з кількох поліпептидних ланцюгів, то спочатку треба розірвати дисульфідні зв’язки методом окислення або відновлення.
При вивченні первинної структури білків інсуліну і рибонуклеази для розщеплення дисульфідних зв’язків використовувалась надмурашина кислота.
Проте використання її має й недоліки. Надмурашина кислота частково руйнує триптофан і не завжди забезпечує окислення всіх дисульфідних зв’язків у білковій молекулі.
Для розщеплення дисульфідних зв’язків часто застосовують і метод відновлення з використанням таких реагентів, як меркаптоетанол, тіогліколева кислота тощо.
Коли в молекулах білка зруйновані дисульфідні зв’язки, виділяють індивідуальні поліпептиди. З цією метою використовують методи іонообмінної хроматографії та електрофорезу в гелі.
Наступний етап роботи пов’язаний з визначенням чергування (послідовності) амінокислотних залишків у виділених полінуклеотидних ланцюгах. Для цього спочатку проводять селективний (вибірковий) частковий гідроліз поліпептидних ланцюгів з участю протеолітичних ферментів або соляної кислоти на менші фрагменти (пептиди). У коротких пептидах значно легше вивчити порядок розміщення залишків амінокислот.
Використання ферментів зумовлює розщеплення пептидних зв’язків між певними амінокислотами. Щоб ферменти не забруднювали досліджуваний білок, застосовують нерозчинні препарати ферментів на спеціальних носіях.
Високу специфічну дію на поліпептидні ланцюги має трипсин. Він, як правило, розриває пептидні зв’язки, утворені карбоксильними групами лізину та аргініну. Трипсин належить до ендопептидаз і гідролізує пептидний зв’язок у тому разі, коли поряд є ще один пептидний зв’язок. Тому вільних амінокислот при гідролізі пептидів трипсином не утворюється.
Інші протеолітичні ферменти (пепсин і хімотрипсин) менш специфічні. Так, пепсин розриває пептидні зв’язки, утворені аміногрупою тирозину, а іноді аміногрупою глутамінової кислоти, гліцину та аланіну. Хімотрипсин гідролізує зв’язки в поліпептиді, утворені карбоксильними групами амінокислот — метіоніну, фенілаланіну, тирозину та деяких інших.
Утворену суміш пептидів піддають попередньому фракціонуванню залежно від їх заряду й розміру, а потім очищають від різних домішок. Ці процеси проводять із застосуванням електрофорезу, іонообмінної хроматографії.
Виділені пептиди (фрагменти) використовують для вивчення послідовності амінокислот у кожному з них.
Послідовність розміщення залишків амінокислот у даних пептидах починають вивчати з N- і С-кінцевих амінокислот. Для визначення N-кінцевих амінокислот, крім ди- нітрофенільного методу, в останнє десятиріччя застосовують фенілтіогідантоїновий метод, або метод Едмана. Суть його полягає в тому, що на білок (пептид) діють фенілізотіоціанатом, що приводить до утворення фенілтіокарбамільного похідного (ФТК-похідного) білка (пептиду), яке під впливом соляної кислоти піддається циклізації. При цьому відщеплюється N-кінцева амінокислота у вигляді фенілтіогідантоїну. Схематично цей процес можна зобразити так:
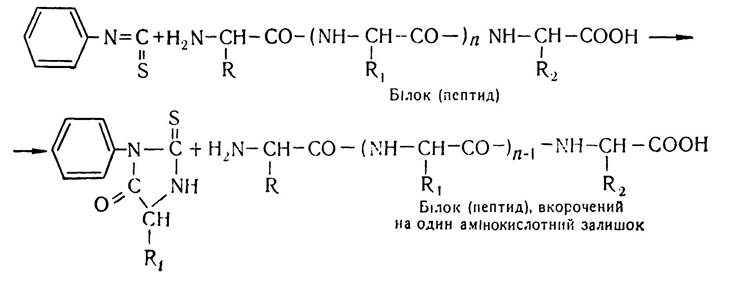
Ідентифікують фенілтіогідантоїн методами хроматографії.
Основна перевага методу Едмана, порівняно з іншими методами, в тому, що білок (пептид), вкорочений на одну амінокислоту, можна виділити в непошкодженому вигляді і піддати новій обробці фенілізотіоціанатом, внаслідок чого знову утвориться фенілтіогідантоїн, в складі якого буде наступна N-кінцева амінокислота. Оскільки цей процес повторюється багато разів, можна вивчити послідовність розміщення амінокислотних залишків у пептидному ланцюгу білкової молекули.
Уже сконструйовано прилад (секвенатор), в якому всі операції (обробка білка (пептиду) фенілізотіоціанатом, гідроліз утвореного продукту і виділення фенілтіогідантоїну) автоматизовано.
Після вивчення первинної структури окремих пептидів з’ясовують, в якій послідовності вони розміщені в поліпеп- тидному ланцюгу. Цього досягають порівнянням пептидів, добутих внаслідок гідролізу одного й того самого білка за допомогою трипсину, хімотрипсину, пепсину.
Постійне вдосконалення методів вивчення порядку розміщення амінокислотних залишків у молекулах білків дало можливість вивчити первинну структуру близько 1000 різних білків. Першим білком, первинна структура якого була вивчена, став інсулін — гормон підшлункової залози, який відіграє важливу роль у регуляції вуглеводного обміну. Це простий білок з відносною молекулярною масою 6000. Побудований він з 16 амінокислот, містить 51 амінокислотний залишок і складається з двох ланцюгів: до складу ланцюга А входить 21 амінокислотний залишок, а до ланцюга В — 30 амінокислотних залишків.
Первинну структуру інсуліну досліджував у 40—50-х роках англійський біохімік Ф. Сенгер. За ці та інші дослідження, пов’язані з вивченням структури білків, Ф. Сенгеру в 1958 р. була присуджена Нобелівська премія.
Після інсуліну було розшифровано первинну структуру іншого білка-ферменту — рибонуклеази. Він складається із 124 амінокислотних залишків.
У 70-х роках під керівництвом радянських учених академіків Ю. А. Озчинникова і О. О. Браунштейна в нашій країні було вивчено первинну структуру ферменту аспартат-амінотрансферази. Цей білок містить 412 амінокислотних залишків. Повністю розшифровано будову поліпептидних ланцюгів ферментів пепсиногену, пепсину, хімотрипсину, карбоксипептидази, глутаматдегідрогенази, альдолази, лізоциму, папаїну, ряду білків, які входять до складу цито- хромів, білка гемоглобіну, міоглобіну та ін.
Успіхи у вивченні первинної структури білків дали можливість добувати їх хімічним синтезом. Характерно, що всі' білки мають властиву для них біологічну активність.
Вивчення первинної структури білків і хімічний синтез деяких з них свідчать, що амінокислотна послідовність є специфічною характеристикою кожного білка. Вона детермінована в поліпептидному ланцюгу і закріплена генетично. Оскільки до складу білків входить 20 різних амінокислот, то в природі теоретично можуть існувати близько 2·1018 ізомерів білків. На основі аналізу даних чергування амінокислотних залишків у поліпептидних ланцюгах різних білків було встановлено ряд цікавих і важливих закономірностей, наприклад, принцип структурної подібності. Суть його в тому, що в поліпептидних ланцюгах різних білків або в різних ділянках поліпептидного ланцюга одного й того самого білка зустрічаються однакові пептидні угруповання. Наприклад, первинна структура інсуліну і рибонуклеази (табл. 4) містить в різних ділянках пептидних ланцюгів три однакових трипептиди і один тетрапептид.
Таблиця 4. Структурна подібність інсуліну і рибонуклеази
Пептидні угруповання |
Інсулін |
||
Ланцюг А |
Ланцюг В |
Рибонуклеаза |
|
Ідентичні трипептиди |
Ала-Сер-Вал 8 9 10 Вал-Цис-Сер 10 11 12 |
Вал-Глу-Ала 12 13 14 |
Ала-Сер-Вал 122 123 124 Вал-Цис-Сер 57 58 59 Вал-Глу-Ала 54 55 56 Асн-Тир-Цис-Асн 24 25 26 27 |
Ідентичні тетрапептиди |
Асн-Тир-Цис- 18 19 20 Асн 21 |
||
Характерною закономірністю є певна подібність первинної структури у білків, які виконують подібні біологічні функції. Прикладом може бути група ферментів, яка каталізує реакції дегідрування різних субстратів. Ця особливість характерна і для ферментів гідролаз, які мають подібний порядок розміщення амінокислотних залишків біля активного центру.
Водночас встановлено, що для білків характерна видова специфічність, яка визначається певною первинною структурою окремих ділянок поліпептидного ланцюга. Так, гормон білкової природи інсулін у різних видів тварин має неоднаковий склад фрагментів ланцюга А в положенні 8—10. Вивчення послідовності амінокислотних залишків у молекулі інсуліну різних видів тварин показало, що зміни, які спостерігаються в молекулі інсуліну при переході від одного виду тварин до іншого, характерні лише для окремих амінокислот. Так, у поліпептидному ланцюгу А в положенні 8 можуть замінити одна одну амінокислоти аланін і треонін, в положенні 9 — серин і гліцин, а в положенні 10 — валін, ізолейцин і треонін (табл. 5).
Відмінності в первинній структурі зустрічаються також в окремих білках одного й того самого виду, що зумовлено, зокрема, мутаціями. Відомо, наприклад, що гемоглобін здорової людини відрізняється від гемоглобіну людини хворої на серповидну анемію лише тим, що залишок глутамінової кислоти в |3-поліпептидному ланцюгу замінений на залишок амінокислоти валіну:
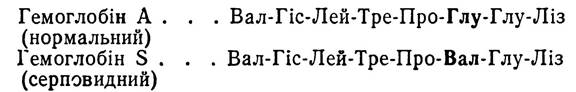
Таблиця 5. Амінокислотні зміни в поліпептидних ланцюгах А молекул інсуліну різних видів тварин і людини
Вид |
Положення амінокислотних залишків в ланцюгу А |
||
8 |
9 |
10 |
|
Бик |
Ала |
Сер |
Вал |
Свиня |
Тре |
Сер |
Іле |
Баран |
Ала |
Глі |
Вал |
Кінь |
Тре |
Глі |
Іле |
Кашалот |
Тре |
Сер |
Іле |
Сейвал |
Ала |
Сер |
Тре |
Собака |
Тре |
Сер |
Іле |
Кролик |
Тре |
Сер |
Іле |
Людина |
Тре |
Сер |
Іле |
Уже вивчено більш як 100 аномальних (патологічних) гемоглобінів і майже в усіх випадках встановлено заміну однієї амінокислоти в α- або β-поліпептидному ланцюгу даного білка. Характерно, що виявлені в аномальних гемоглобінах зміни часто стосуються гідрофільних амінокислот. Вивчення первинної структури цілого ряду білків дає можливість з’ясувати на молекулярному рівні механізми виникнення багатьох спадкових захворювань.
Вторинна структура білків. Під вторинною структурою білків розуміють просторову конфігурацію поліпептидного ланцюга. Встановленню вторинної структури білка передували тривалі і численні дослідження структури ряду амінокислот і пептидів за допомогою рентгеноструктурного аналізу. Це дало можливість встановити окремі закономірності пептидного зв’язку, а також імовірних конформацій пептидних ланцюгів. На основі даних рентгено-структурного аналізу американські вчені Л. Полінг і Р. Корі запропонували модель вторинної структури білка у вигляді α-спіралі (мал. 6).

Мал. 6. Модель поліпептидного ланцюга за Полінгом і Корі (α-спіраль).
Вона являє собою гвинтоподібну закручену структуру. У природі можливе існування двох типів спіралі — закрученої вправо і закрученої вліво. Проте дані, здобуті на основі рент-геноструктурного аналізу білків, свідчать про наявність у них спіралі, закрученої вправо. Це певною мірою може пов’язуватись з тим, що до складу білків входять лише амінокислоти L-ряду.
Просторова конфігурація а-спіралі характеризується такими даними: на один виток а-спіралі припадає 3,6 амінокислотного залишку, а крок спіралі (відстань між витками)становить 54 нм. Кут підйому витка дорівнює 26°, а висота одного амінокислотного залишку 0,15 нм. Період ідентичності, тобто довжина відрізка спіралі, яка повністю повторюється, 2,7 нм і включає в себе 18 залишків амінокислот.
Важливу роль у стабілізації вторинної структури білка відіграють водневі зв’язки. В а-спіралі вони виникають між. киснем карбонільної і воднем імінної груп сусідніх звивів поліпептидного ланцюга. Слід зазначити, що хоч енергія утворення водневого зв’язку і невелика, але значна кількість їх зумовлює достатню стійкість і жорсткість а-спіралі. Проте у водному середовищі a-структура може бути менш стійкою, оскільки вода конкурує з білком, утворюючи водневі зв’язки.
Стабільність білкової структури визначається й іншими факторами, зокрема боковими групами (радикалами) амінокислотних залишків, розміщених на різних ділянках поліпептидного ланцюга. Так, дослідження з поліаланіном, радикали якого за величиною незначні і не мають заряду, показали, що він самовільно утворює а-спіральну структуру у водному розчині при pH 7,0. Поліпептид на основі іншої амінокислоти — лізину, тобто полілізин, при цьому самому значенні pH не утворює α-спіралі, а існує у вигляді невпорядкованого клубка. У нейтральному середовищі радикали лізину мають позитивний заряд, що не дає їм можливості
наблизитись один до одного, оскільки діють сили відштовхування, які перешкоджають утворенню поліпептидом внутріландюгових водневих зв’язків. Подібні експерименти були проведені з іншими поліамінокислотами. Це дало можливість встановити, що ряд амінокислот — аланін, валін, лейцин, метіонін, фенілаланін, тирозин, триптофан, гістидин та деякі інші — сприяють утворенню α-спіралі, особливо коли вони розміщені в поліпептидному ланцюгу поряд. А такі амінокислоти, як лізин, аргінін, тирозин, серин, треонін, аспарагінова і глутамінова кислоти, сприяють дестабілізації α-спіралі. Деякі амінокислоти, наприклад пролін і окси-пролін, не вкладаються в спіральну структуру. На цих ділянках напрям поліпептидного ланцюга змінюється на 103° і спіральна структура порушується.
Це, очевидно, є однією з причин того, що поліпептидні ланцюги в молекулах деяких білків спіралізовані не повністю. Такі випадки зустрічаються досить рідко. Для кожного білка характерний певний ступінь спіралізації поліпептидного ланцюга (табл. 6).
Таблиця 6. Ступінь спіралізації поліпептидних ланцюгів
(за Девісом, 1965 р.)
Назва білка |
Ступінь спіралізації, % |
Параміозин |
100 |
Міоглобін |
75 |
Гемоглобін |
75 |
Альбумін сироватки крові |
50 |
Альбумін курячого яйця |
45 |
Лізоцим |
35 |
Вірус тютюнової мозаїки (субодиниця) |
30 |
Пепсин Рибонуклеаза |
28 17 |
Хімотрипсин |
11 |
Отже, під вторинною структурою білка слід розуміти співвідношення спіралізованих ділянок поліпептидного ланцюга з лінійними, нерегулярними, аморфними переходами, в яких порушені водневі зв’язки.
Дослідження структури різних білків показали, що, крім α-спіралі, може існувати інша впорядкована конформація поліпептидного ланцюга, відома під назвою β-структури. Для її утворення поліпептидні ланцюги повинні бути до певної міри витягнутими і розміщеними паралельно. Стабілізація β-структури, як і α-спіралі, відбувається за рахунок водневих зв’язків. Вважають, що β-структура може існувати в двох різновидностях. Перша дістала назву антипаралельного складчастого шару. Вона утворена поліпептидними ланцюгами, амінокислотні залишки яких спрямовані в різні боки. Друга різновидність β-структури називається паралельним складчастим шаром. Утворюється вона в тому разі, коли в поліпептидних ланцюгах напрям амінокислотних залишків збігається.
β-структура характерна для фібрилярних білків — фіброїну (білок шовку), кератину (білок сполучної тканини), міозину (білок м’язів) та деяких інших.
Отже, а-спіраль і p-структура — другий рівень або порядок структурної організації молекули білка, тобто вторинна структура, у стабілізації якої важливу роль відіграють водневі зв’язки.
Третинна структура білків. Цей рівень структури характеризується певною конформацією спіралізованих і лінійних ділянок поліпептидних ланцюгів у просторі. Іншими словами, третинна структура — це укладання вторинних структур поліпептидних ланцюгів з утворенням: глобул різної форми.
Для кожного білка характерна своя третинна структура, від якої залежать його специфічні біологічні властивості. Третинна структура значною мірою визначається первинною структурою білків, тобто порядком чергування амінокислотних залишків в їх молекулах, розміром, формою і полярністю радикалів амінокислотних залишків. Слід зазначити, що поліпептидні ланцюги не просто укладаються, утворюючи структури, близькі до сферичної, а укладаються через цілий ряд точно визначених станів, утворюючи унікальну конформацію молекули білка. У процесі формування третинної структури поліпептидні ланцюги укладаються таким! чином, щоб максимальна кількість гідрофільних груп залишків амінокислот була розміщена назовні, тобто повернута до водного середовища, а гідрофобні групи розміщуються всередині структури (глобули). На конформацію утвореної глобули значно впливають такі фактори, як pH середовища, іонна сила розчину, температура, взаємодія білкових молекул з іншими речовинами тощо.
Незначне порушення третинної структури білка, як правило, призводить до втрати ним біологічних властивостей. У стабілізації третинної структури білка важливу роль, відіграють водневі, дисульфідні, іонні та гідрофобні зв’язки. Вони діють тоді, коли поліпептидний ланцюг набуває відповідної конфігурації, що властива нативній молекулі білка. Загальні положення щодо сил, які стабілізують структуру білкової глобули, були встановлені ще в 1944 р. радянськими вченими. Так, дисульфідні зв’язки можуть виникати самовільно внаслідок наближення двох сульфгідрильних груп залишків цистеїну. Ці зв’язки є ковалентними і порівняно з іншими зв’язками характеризуються високою міцністю. Проте наявність дисульфідних зв’язків не є обов’язковою для всіх білків. Відомі білки, в яких немає цих зв’язків, наприклад гемоглобін, міоглобін, білок вірусу тютюнової мозаїки, білки кишкової палички та деякі інші. Водночас, руйнування дисульфідних зв’язків у білках, де вони є, призводить до втрати ними специфічних біологічних властивостей і зменшує стабільність білкової молекули.
Вважають, що серед нековалентних зв’язків найбільше значення для стабілізації третинної структури білка мають гідрофобні зв’язки. Вони утворюються при наявності в поліпептидному ланцюгу радикалів таких амінокислот, як валін, лейцин, ізолейцин, фенілаланін, триптофан.
Ряд досліджень, проведених в останні роки, свідчать, що важливе значення в стабілізації третинної структури білка відіграють водневі та іонні зв’язки.
Нині з’ясовано третинну структуру багатьох десятків різних білків. Вперше розшифрував третинну структуру білка міоглобіну англійський дослідник Дж. Кендрю в 1957 р.
Міоглобін — білок з порівняно невеликою відносною молекулярною масою 17 500. Молекула його побудована з одного поліпептидного ланцюга, який містить 153 амінокислотних залишки. Понад 70 % поліпептидного ланцюга міоглобіну спіралізовано. Неспіралізовані ділянки містять велику кількість проліну. У міоглобіну, виділеного з різних видів тварин, конформація поліпептидних ланцюгів подібна, але вони дещо відрізняються між собою амінокислотним складом.
Англійський учений М. Перутц встановив третинну структуру складнішого білка — гемоглобіну, що складається з чотирьох субодиниць. Кожна субодиниця за своєю будовою близька до міоглобіну. Міоглобін і гемоглобін мають подібні функції — гемоглобін зв’язує і переносить кисень до тканин організму, міоглобін є резервом кисню в м’язах тварин. До структури обох білків входить залізопорфіриновий комплекс.
У другій половині 60-х років була досить докладно з’ясована третинна структура білка-ферменту лізоциму, побудованого з одного поліпептидного ланцюга. Причому вдало ся встановити положення всіх 129 залишків амінокислот, які утворюють поліпептидний ланцюг даного білка. Було з’ясовано, що при укладанні поліпептидного ланцюга лізоциму утворюється ніша певної форми, в якій розміщений активний центр, що взаємодіє з відповідним субстратом.
Встановлено структури таких білків, як рибонуклеаза, альдолаза, лактадегідрогеназа, карбоангідраза, папаїн, пепсин, трипсин, хімотрипсин та ін. Дослідження, проведені при цьому, ще раз свідчать, що третинна структура є досить складною, унікальною і специфічною для кожної білкової молекули.
Четвертинна структура білків. Застосування рентгеноструктурного методу аналізу та електронної мікроскопії дало можливість встановити, що для білків, молекули яких побудовані з одного поліпептидного ланцюга, властиві лише первинна, вторинна і третинна структури. Четвертинну структуру мають білки, які складаються з двох, чотирьох і більшої (парної) кількості індивідуальних поліпептидних ланцюгів з власною третинною структурою. Такі поліпептидні ланцюги називають протомерами, або субодчницями, а білки, що складаються з них — олігомерами. Отже, взаємне просторове розміщення протомерів (субодиниць) у білковій молекулі і становить її четвертинну структуру.
Протомери, що становлять четвертинну структуру білка, за амінокислотним складом можуть бути однаковими або різними. Вважають, що білки з відносною молекулярною масою понад 50 000 побудовані з кількох поліпептидних ланцюгів (протомерів).
Класичним прикладом білка з четвертинною структурою є гемоглобін, що складається з чотирьох протомерів (двох α- і двох β-поліпептидних ланцюгів). Протомери, побудовані з α-ланцюгів, містять по 141 амінокислотному залишку, а з β-ланцюгів — по 146. Ці протомери, сполучаючись між собою, утворюють молекулу гемоглобіну (мал. 7). Відносна молекулярна маса гемоглобіну дорівнює 68 000, а кожного протомеру— 17 000. Характерним є те, що гемоглобін у процесі приєднання і віддачі кисню дещо змінює конформацію четвертинної структури.
Мал. 7. Структура α-ланцюга (1), (β-ланцюга (2) і цілої молекули гемоглобіну (3) за даними рентгеноструктурного аналізу.
Приєднання кисню супроводжується стисненням його молекули внаслідок зближення протомерів. Віддача кисню зумовлює протилежний ефект.
Білок вірусу тютюнової мозаїки також має четвертинну структуру, відносна молекулярна маса його близько 40 млн. До складу молекули цього білка входить майже 2200 однакових протомерів з відносною молекулярною масою 17 500; вони розміщені по спіралі. Зовсім недавно з’ясовано четвертинну структуру білка жовтої мозаїки ріпи, який має відносну молекулярну масу близько 5 млн. і складається з 180 однакових субодиниць.
Четвертинна структура білків лежить в основі будови цілого ряду білків-ферментів і має безпосереднє відношення до існування ізоферментів. Наприклад, якщо молекула білка-ферменту складається з чотирьох протомерів типу А і В, то фермент може існувати в п’яти ізоформах: АААА, АААВ, ААВВ, АВВВ, ВВВВ, тобто можливе існування п’яти ізоферментів, які відрізняються між собою більшою або меншою каталітичною активністю. Утворення ізоферментів — важливий процес регуляції активності ферментних систем. Ізоформи ферменту властиві для лактатдегідрогенази і деяких інших ферментів.
Четвертинна структура білків стабілізується і підтримується в нативному стані з участю нековалентних зв’язків, які утворюються між різними функціональними групами, що містяться на поверхні протомерів (білкових глобул). Під впливом різних фізичних або хімічних факторів відбувається дисоціація білків на окремі протомери. При цьому білки втрачають свою біологічну активність. Факторами, які викликають їх дисоціацію, можуть бути органічні розчинники,, сечовина, зміна pH середовища тощо. Якщо усунути фактор, що зумовлює дисоціацію, то протомери знову сполучаються між собою з утворенням четвертинної структури білка. При цьому відновлюється його біологічна активність, що свідчить про тісний взаємозв’язок між структурою і функціями білка.
Функції та роль білка в організмі
У природі існує велика кількість білків. До складу живих організмів входить 1 • 1012 білків, з них близько 5 млн. різних білків — до складу організму людини і тварин. Кожний з цих білків виконує певні властиві йому функції, які визначають його участь у процесах життєдіяльності. Одні білки забезпечують рух і м’язові скорочення, інші — імунні чи каталітичні процеси, визначають структуру органів і тканин організму, сприяють процесам росту, розвитку і самовідтворення.
Однією з досить важливих функцій білків є структурна (пластична) функція, завдяки якій білки становлять основу будови організмів, входять до складу всіх органів і тканин, беруть участь в утворенні остова клітин та їх органел — мембранних структур, мітохондрій, рибосом, цитоплазми. Білки — основні компоненти біологічних мембран і виконують у них різноманітні функції — структурну, регуляторну, каталітичну. Специфіка мембран та роль їх визначаються насамперед білковим компонентом. У вищих тварин і людини білки беруть участь в утворенні стінок судин, у формуванні покривних, м’язових, сполучних тканин організму, становлять основу органічної частини кісткової тканини, хрящів, зв’язок і сухожилля. Важливу роль відіграють білки також і в утворенні різноманітних структур у рослинних організмах. Усі апарати рослинних клітин і тканин, що підтримують життєдіяльність, утворені з різноманітних білкових сполук.
Білки становлять у середньому 10—21 % сирої маси тіла людини і тварин та близько 50 % їх сухої маси. В окремих органах і тканинах вміст їх може змінюватись в широких межах, що пов’язано з особливостями структури і функціями цих органів і тканин.
Зокрема, високий вміст білків — понад 85 % У перерахунку на сиру масу, у клітинах, які перебувають у фізіологічно активному стані.
Вміст білків в окремих органах і тканинах, у перерахунку на сиру масу, у середньому такий (в %):
М’язи |
18—23 |
Мозок |
7—9 |
Листя |
1,0—3,0 |
Печінка |
17—19 |
Жирова тканина |
6—0 |
Коріння |
0,5—3,0 |
Серце |
16—18 |
Насіння рослин |
10—13 |
Овочі і, фрукти |
0,3—1,6 |
Легені |
12—15 |
Стебла |
1,5—3,0 |
Пластична функція білків в організмі зумовлена здатністю їх разом з іншими біомолекулами організму (вуглеводами, ліпідами, нуклеїновими кислотами) утворювати надмолекулярні комплекси, що забезпечують утворення різноманітних субклітинних структур тканин і органів.
В організмі людини і тварин білки виконують каталітичну функцію, тобто є специфічними регуляторами і каталізаторами багатьох біохімічних процесів. Усі ферменти — біологічні каталізатори, що зумовлюють спрямованість і швидкість хімічних реакцій, які лежать в основі, обміну речовин, мають білкову природу. Ферменти каталізують реакції, що спричиняють хімічні перетворення різноманітних речовин, необхідних для утворення енергії, яка забезпечує метаболічні процеси і є необхідною умовою життєдіяльності. Відомо більш як 17 000 білків, які мають ферментативну активність, понад 200 з них виділено в кристалічному стані.
З участю ферментів у клітині відбуваються одночасно тисячі різних хімічних реакцій, які забезпечують синтез і розпад різноманітних сполук, причому при звичайній температурі і тиску, без застосування хімічних реагентів і досить швидко. Так, одна молекула ферменту каталази за одну хвилину каталізує розщеплення 5 млн. молекул пероксиду водню. Отже, білки є основою не тільки структури організму, а й обміну речовин — однієї з найважливіших ознак живого.
Білки беруть участь в регуляції процесів метаболізму. Регуляторна роль білків здійснюється з участю гормонів, які виділяються залозами внутрішньої секреції і контролюють рівень обмінних процесів в організмі. Більшість гормонів мають білкову природу або є продуктами білкового обміну. Це, зокрема, такі гормони, як інсулін, тетелін, тиреотропін, тироксин, адренокортикотропний гормон, окситоцин, вазопресин та ін. Продуктами білкового обміну є також медіатори центральної нервової системи: гістамін, серотонін, γ-аміномасляна кислота та ін. Крім того, окремі гормони пептидної природи беруть участь у синтезі та регуляції активності ферментів, створюючи таким чином збалансовану систему, яка дає змогу організму активно реагувати на зміну умов навколишнього середовища. Регуляція обмінних процесів з участю гормонів відбувається в результаті впливу їх на проникність клітинних мембран, регуляції активності ферментів, виливом на процеси трансляції і транскрипції та ін.
Важливу роль відіграють білки також в регуляції активності геному. Вивченню структури, функцій і особливостей білків-регуляторів активності геному приділяється велика увага. Вважають, що в хроматині клітинних ядер містяться специфічні білки, які мають здатність до асоціації з ДНК за рахунок іонних зв’язків і сил міжмолекулярної взаємодії, таким чином білки стабілізують молекулу ДНК. Та оскільки для забезпечення матричної активності необхідна дестабілізація її структури, то здатність ДНК до реплікації відновлюється лише при ослабленні зв’язків між ДНК і молекулами білків, які в даному випадку і виступають регуляторами активності геному.
Важливу роль відіграють білки у забезпеченні процесів росту і розмноження — «відтворення собі подібних» та передачі спадкових ознак, особливо складні білки нуклеопро- теїди, до складу яких входять біополімери — нуклеїнові кислоти та білки гістони.
Важливе значення має захисна функція білків, що реалізується з участю у-глобулінів, з якими пов’язані імунні реакції організму. Антитіла, які утворюються в організмі при несприятливому впливі на нього різних факторів — хвороботворних бактерій, вірусів, токсинів — мають білкову природу. Зв’язуючись з мікроорганізмами та токсинами (антигенами), антитіла інактивують їх, гальмують патогенну дію і знешкоджують токсичні продукти. Білки, що утворюються в організмі як реакція їх на токсичну дію, називаються імуноглобулінами (Ig). Існує 5 видів імуноглобулінів (IgG, IgM, IgA, IgD, IgE).
Важливою захисною функцією білків є участь їх у процесах зсідання крові. Це оберігає організм від надмірної крововтрати при різних травмах, пошкодженні органів і тканин. Процеси зсідання крові забезпечуються білком фібриногеном, який при пошкодженні кровоносних судин перетворюється у фібрин, випадає в осад і закриває просвіт кровоносної судини, припиняючи кровотечу.
Одним з важливих проявів життєдіяльності живих організмів є рух. Забезпечення різних форм механічного руху — скорочення і розслаблення м’язів, робота внутрішніх органів (серця, мозку, легень, шлунку) відбувається з участю скоротливих білків — актину, міозину, тропоміозину. Ці білки забезпечують механохімічні процеси перетворення хімічної енергії в механічну. Вони трансформують хімічну енергію макроергічних сполук у механічну енергію м’язового скорочення. На цьому процесі грунтується механічний рух. Радянські біохіміки В. О. Енгельгардт і М. Н. Люби- мова довели, що скоротливий білок міозин ферментативний — прискорює гідроліз найважливішого акумулятора енергії АТФ, утворюючи АДФ і неорганічний фосфат. Енергія, що виділяється при цьому, використовується м’язами. Таким чином, білок міозин виконує дві функції — регулює вивільнення енергії та її використання в процесі роботи м’язів.
З участю білків відбувається енергозабезпечення різних видів робіт на внутріклітинному рівні, оскільки білки мають здатність трансформувати енергію окислення поживних речовин або сонячних променів в електричну енергію, що зумовлює утворення потенціалів на мембранах мітохондрій і хлоропластів. Ця енергія і використовується для виконання різної роботи або переноситься вздовж мембран і є транспортною формою енергії.
Білки забезпечують механізми самозбирання і саморегулювання біологічних систем (складних ферментних комплексів, цитоплазматичних структур, вірусних частинок та ін.) на молекулярному рівні, оскільки вони мають здатність розпізнавати певні молекули серед великої кількості інших молекул.
Досить важливою для організму є транспортна функція білків, завдяки якій відбувається транспорт енергетичних і біологічно активних сполук — жирів, ліпоїдів, жиророзчинних вітамінів. Суть транспортної функції в тому, що білки мають здатність утворювати тимчасові комплекси з різними речовинами і транспортувати їх до різних тканин організму. Одним з транспортних білків є гемоглобін, який забезпечує транспорт кисню до різних органів і тканин та оксиду вуглецю (IV) в зворотному напрямі. Гемоглобін міститься в еритроцитах вищих тварин і людини і становить 90 % їх вмісту. У деяких представників нижчих організмів — молюсків, ракоподібних — еритроцити відсутні і гемоглобін розчинений прямо в цитоплазмі. У кальмарів, головоногих молюсків транспорт кисню забезпечується мідьвмісним білком — гемоціаном, який зумовлює голубий колір крові цих тварин.
Білок — сироватковий альбумін — зв’язує і переносить жирні кислоти, стероїдні гормони та різні продукти метаболізму, аніони і катіони. Цей білок зв’язує 50 % кальцію переносить іони Си2+ з кишечника в печінку. З інших білків, які мають транспортну функцію, слід згадати церулоплазмін. Він транспортує мідь з печінки в органели клітин.
Білок трансфернії транспортує іони заліза, ліпопротеїди, які в свою чергу забезпечують транспорт ліпідів і жиророзчинних вітамінів. Зокрема, ліпопротеїди низької щільності щоденно транспортують 25—50 г ендогенних тригліцеридів, інші забезпечують транспорт холестерину, каротину, вуглеводів, фосфоліпідів. Транспортні білки в організмі функціонують як на рівні макроструктур (кровоносна система, лімфа), так і на рівні мікроструктур (клітина, субклітинні утворення).
Досить важливою функцією білків є передача сигналів через клітинні мембрани — сигнальна, або рецепторна. Прийом сигналів і передача їх у внутріклітинні: центри лежать в основі ще однієї важливої ознаки живого — подразливості. При цьому подразники — хімічні чи механічні — зумовлюють певні зміни в структурі білків, що є своєрідною реакцією клітин на зовнішнє подразнення. Такий принцип діяльності нервової системи, мозку.
Механізм рецепції полягає у сприйманні рецепторними білками енергії подразнення, перетворенні цієї енергії особливими білковими молекулами в спеціальну інформацію і передачі цієї інформації в центральну нервову систему. Рецепторні білки містяться в мембранному апараті клітин і є місцем діяльності цілого ряду гормонів. Зокрема, рецепторний білок, асоційований з аденілатциклазою, під впливом гормону пептидної природи глюкагону змінює свою конформацію, що приводить до активування зв’язаної з ним аденілатциклази, ферменту, який стимулює синтез цАМФ і прискорює процес фосфоролізу глікогену. Цей процес відбувається в результаті протеїнкіназних реакцій і перетворення неактивної фосфорилази В в активну фосфорилазу А. Прикладом фоторецепторних білків є білок опсин, який має здатність утворювати комплекс з альдегідною формою вітаміну А — ретиналем, внаслідок чого білок змінює властиву для нього конформацію, що сприяє виникненню нервових імпульсів і забезпеченню акту зору.
У сприйманні звукових коливань і перетворенні їх у нервові імпульси важливу роль відіграють холінрецепторні білки. Ці білки впливають також на проникність клітинних мембран.
Білки — важливі складові частини продуктів харчування, нестача або відсутність їх у харчовому раціоні людини і тварин призводить до порушення обмінних процесів в організмі і виникнення різних захворювань. У харчуванні їх неможливо замінити будь-якими іншими речовинами. Білки широко використовуються також у різних галузях народно
го господарства. Природними білковими волокнами е шерсть, шовк. Для виготовлення желатину, шкіргалантереї них виробів, пластмас, медичних білкових препаратів — гормонів, антисироваток, кровозамінників — також використовують білки.
Як бачимо, білки забезпечують процеси життєдіяльності організмів, що й зумовило бурхливий розвиток досліджень у цій галузі, яка з проблеми біохімічної перетворилась в одну з найважливіших проблем сучасної біології і медицини. Багатоплановість і важливість проблеми вивчення білка зумовлена тим, що з нею пов’язане розв’язання важливого питання про закономірності розвитку живої матерії, пізнання вищої форми її існування, розкриття суті явищ, які лежать в основі життя та їх свідомого керування. Тому] можна стверджувати, що розвиток і успіхи багатьох галузей біології, медицини, сільського господарства значною мірою залежать від розвитку хімії і біохімії білка.