БІОХІМІЯ ДЛЯ ВЧИТЕЛЯ - Ф.Ф. БОЄЧКО - 1985
ОСНОВНІ ХІМІЧНІ КОМПОНЕНТИ КЛІТИН
БІОСИНТЕЗ БІЛКА
Білковий синтез — одна з найскладніших і найважливіших проблем сучасного природознавства. З її розробкою і вивченням тісно пов’язані найактуальніші питання біологічної науки: з’ясування законів спадковості і мінливості, керування ростом і розвитком організмів, розкриття причин виникнення і розробка методів профілактики та лікування багатьох спадкових захворювань та ін.
Перша гіпотеза відносно синтезу білка була запропонована О. Я. Данилевським ще в 1886 р. Це так звана гіпотеза зворотного протеолізу, або утворення білковоподібних речовин (пластеїнів) внаслідок дії ферментів шлункового соку на концентрований розчин пептонів — продуктів гідролізу білка. Однак, як було встановлено пізніше, такий спосіб утворення білків не відіграє істотної ролі в організмі. Згодом було запропоновано інші гіпотези, однак жодна з них не могла розкрити механізму білкового синтезу.
Кілька десятиріч тому в науковій літературі було висловлено припущення відносно реплікації білкових молекул на якомусь «шаблоні», з’явились перші спроби пов’язати синтез білка з такими важливими біополімерами клітин, як нуклеїнові кислоти. Так поступово почала формуватись матрична теорія білкового синтезу, яка відіграла важливу роль у розкритті цієї фундаментальної проблеми.
У з’ясуванні механізмів участі нуклеїнових кислот у синтезі білка велике значення мали праці радянських учених А. М. Білозерського і О. С. Спіріна, зарубіжних дослідників Д. Уотсона, Ф. Кріка, С. Очоа, М. Ніренберга та ін.
Відомо, що білки, які синтезуються в організмі, відрізняються один від одного насамперед хімічною природою і послідовністю розміщення залишків амінокислот у поліпептидних ланцюгах, тобто первинною структурою. Інформація про те, яким повинен бути білок, закладена в ДНК у вигляді певної послідовності нуклеотидних залишків у полінуклеотидному ланцюгу. Оскільки ДНК міститься в ядрі, а біосинтез білка відбувається на рибосомах, то вона передає свою інформацію про синтез білка через іРНК, яка синтезується на певній ділянці (гені) одного з нуклеотидних ланцюгів ДНК.
В основі передачі інформації лежить принцип компле- ментарності. У синтезованій іРНК послідовність нуклеотидів відповідає послідовності нуклеотидів в одному з по- лінуклеотидних ланцюгів ДНК. Відмінність полягає лише в тому, що замість тимідинового нуклеотиду в іРНК міститься уридиновий нуклеотид. Процес переписування даної інформації з ДНК на ІРНК називається транскрипцією.
Одержавши інформацію від ДНК, ІРНК виходить з ядра і переміщується до рибосом. На рибосомах ІРНК реалізує здобуту інформацію в процесі синтезу білка. Іншими словами, на ІРНК, як на матриці, відбувається синтез білка, первинна структура якого визначається інформацією, яку іРНК дістала від ДНК. Процес передачі інформації з іРНК, що записана в певній послідовності чергування нуклеотидів в її молекулі, на мову розміщення амінокислотних залишків у білкових молекулах називається трансляцією.
Отже, передачу інформації від ДНК на синтез білка можна показати такою схемою:
![]()
Для синтезу білків використовуються активовані форми амінокислот, які зв’язані з відповідними тРНК. Останні переносять їх до місця біосинтезу білка — рибосом. Процес сполучення амінокислот з тРНК з участю ферменту — аміноацил-тРНК-синтетази часто називають рекогніцією (від англ. recognize — пізнавати).
За сучасними даними, біосинтез білків відбувається через ряд складних біохімічних процесів, в яких беруть участь нуклеїнові кислоти, різні ферментні системи, іони металів та ряд інших факторів. Він включає в себе такі основні стадії: транскрипцію, рекогніцію і трансляцію.
Активація амінокислот і утворення аміноацил-тРНК (рекогніція). Активація амінокислот відбувається в цитоплазмі клітин з участю багатої на енергію АТФ і ферментів — аміноацил-тРНК-синтетаз (аміноацилсинтетаз). Для кожної амінокислоти в клітині існує свій специфічний фермент. Академік В. О. Енгельгардт назвав ці ферменти кодазами. Щоб вони проявили максимальну активність, необхідні іони магнію. Дещо меншу активуючу дію мають іони інших двовалентних металів, зокрема марганцю, кобальту і кальцію. Реакцію активації амінокислот можна показати такою схемою:
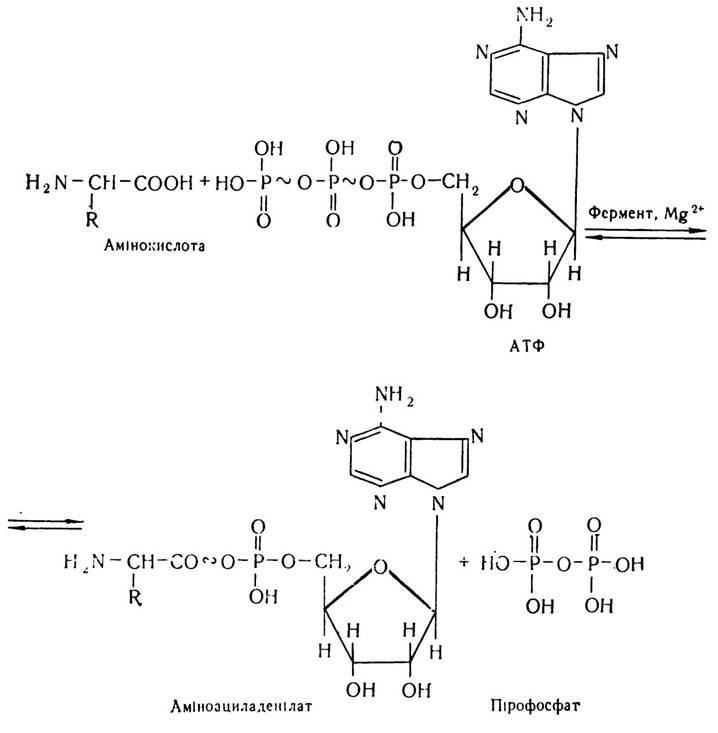
Ця реакція відбувається на поверхні каталізуючого її ферменту, утворений аміноациладенілат не переходить в розчин, а залишається в комплексі з ферментом. У молекулі аміноациладенілату залишок амінокислоти з’єднується із залишком АТФ макроергічним зв’язком, який підвищує реакційну здатність амінокислоти.
На наступному етапі комплекс аміноациладенілату з ферментом взаємодіє з тРНК, специфічною для відповідної амінокислоти. При цьому відбувається перенесення аміноацильної групи з аміноациладенілату на тРНК з утворенням нового комплексу — аміноацил-тРНК. - При цьому виділяються АМФ і фермент.
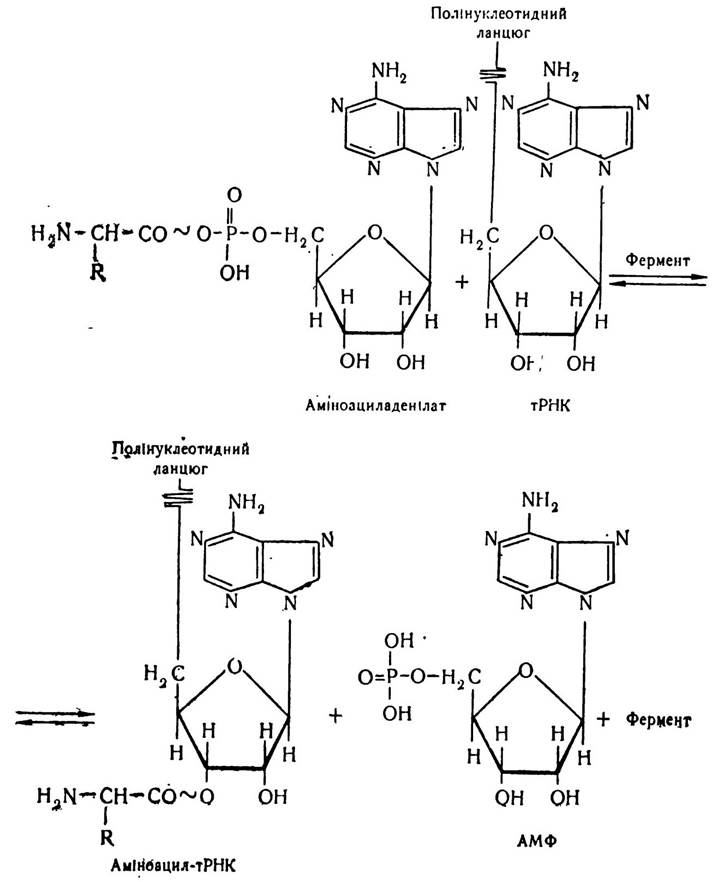
Залишок амінокислоти приєднується до третього атома вуглецю рибози кінцевого нуклеотиду тРНК із збереженням макроергічного зв’язку. Цю реакцію каталізує той самий фермент, що й реакцію активації амінокислоти— аміноацил-тРНК-синтетаза. У молекулі добутого ферменту є дві специфічні ділянки, які дають йому можливість пізнавати з одного боку «свою» амінокислоту, а з другого — «свою» тРНК.
Трансляція — це переведення нуклеотидної послідовності іРНК в амінокислотну послідовність поліпептид- ного ланцюга в процесі білкового синтезу. Цей етап синтезу білка відбувається на рибосомах і складається з таких послідовних стадій: ініціації, елонгації і термінації. Процес трансляції найбільш докладно вивчено на бактеріальних клітинах.
Відомо, що рибосоми бактеріальних клітин, як і клітин вищих організмів,— це рибонуклеопротеїдні комплекси, побудовані з білків і рибонуклеїнових кислот рРНК, які синтезуються на матриці ДНК в ядерцях. Розміри рибосом характеризуються константами седиментації, які виражають одиницями Сведберга (S). Чим більші частинки, тим швидше вони осаджуються внаслідок ультрацентрифугування і тим вища константа їх седиментації. Для прокаріотів характерні рибосоми, що мають константу седиментації 70S, а для евкаріотів — відповідно 80S.
Кожна рибосома складається з двох субодиниць — малої і великої, на які вона може дисоціювати при певних умовах. Для прокаріотів характерними є мала 30S-i велика 50S-субодиниці, а для евкаріотів — 40S і 60S.
Здатність рибосом розпадатись на субодиниці (дисоціювати), а потім знову з’єднуватись (асоціювати) має важливе значення в процесі білкового синтезу.
Ініціація. Цей процес білкового синтезу був докладно вивчений на прикладі бактерій кишкової палички. При дослідженні білків бактеріальних клітин було виявлено, що досить часто N-кінцевою амінокислотою в них є метіонін, тобто синтез білків завжди починається з метіоніну. Було встановлено, що в бактеріальних клітинах, крім звичайної тРНКмет, яка доставляє метіонін до рибосом, існує ще одна тРНК, так звана ініціаторна тРНК, яка транспортує формілметіонін (тРНКмет). Обидві тРНК
пізнають на структурі ІРНК триплет АУГ, однак тРНКмет транспортує метіонін до триплетів, розміщених на внутрішніх ділянках іРНК, a тPHKмет — до триплету, розміщеного на 5'-кінці полінуклеотидного ланцюга іРНК. Роль формілметіоніну полягає в тому, що він містить зв’язану (формільовану) аміногрупу, а тому перший пептидний зв’язок може утворюватись лише за рахунок карбоксильної групи, і синтез поліпептиду відбуватиметься в напрямі від N- до С-кінця. Після закінчення синтезу поліпептид- ного ланцюга формільна група або повністю формілметіонін відщеплюється, і N-кінцевою стає наступна за метіоніном амінокислота.
Встановлено, що для ініціації білкового синтезу необхідні такі компоненти: іРНК, тРНКфмет, ГТФ, 30S- і 50S-субодиниці рибосом та білкові фактори ініціації IF-1, IF-2, IF-3. Спочатку з участю факторів IF-3 і IF-2, в присутності ГТФ 30S-субодиниця взаємодіє з формілметіоніл-тРНК. Потім цей комплекс в присутності фактора IF-I з’єднується з іРНК і утворюється ініціюючий комплекс. Останній взаємодіє з 50S-субодиницею рибосоми. При цьому вивільняються фактори ініціації і відбувається розщеплення ГТФ на ГДФ і Н3РО4. За цих умов утворюється функціонально активна рибосома (70S-pибосомa іРНК-тРНК).
Функціонально активна рибосома містить дві ділянки: аміноацильну (A-ділянку) і пептидильну (П-ділянку).
Формілметіоніл-тРНК потрапляє спочатку в А-ділянку, а потім переноситься в П-ділянку. При цьому А-ділянка вивільнюється і готова приймати наступну (другу) аміноацил-тРНК. На цьому процес ініціації закінчується.
Елонгація (ріст поліпептидного ланцюга) також відбувається кількома етапами. Перший етап полягає в доставці наступної аміноацил-тРНК в A-ділянку рибосоми і зв’язуванні її з відповідним кодом іРНК, який розміщений поряд з ініціюючим кодом (АУГ). У цьому процесі беруть участь ГТФ і фактори елонгації EF — Ти і EF — Ts.
На наступному етапі елонгації відбувається утворення першого пептидного зв’язку в A-ділянці рибосоми, де міститься принесена аміноцил-тРНК. Сюди з П-ділянки переноситься тРНКфмет і відбувається утворення першого пептидного зв’язку внаслідок взаємодії карбоксильної групи формілметіоніну та аміногрупи принесеної амінокислоти у вигляді аміноцил-тРНК. За цих умов утворюється пептидил-тРНК і звільняється тРНК:
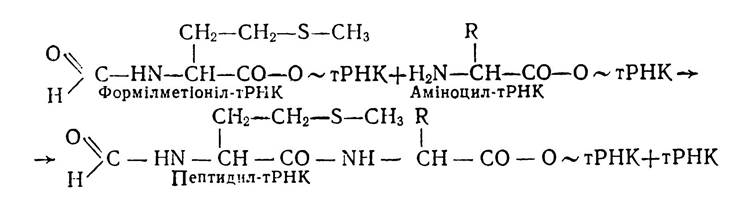
Звільнена тРНК міститься в П-ділянці, а пептидил- тРНК в A-ділянці рибосоми.
На третьому етапі елонгації відбувається переміщення (транслокація) пептидил-тРНК в П-ділянку. При цьому видаляється з П-ділянки вільна тРНК і переміщується іРНК на довжину одного кодону. A-ділянка за цих умов звільняється і може приймати наступну (третю) амінокислоту.
Термінація (закінчення синтезу поліпептидного ланцюга) наступає при появі в структурі РНК певних сигналів, якими є триплети УАА, УАГ і УГА. їх часто називають беззмістовними, термінаторними, або нонсенс-триплетами.
У процесі термінації беруть участь фактори RFi і RF2, які каталізують відщещпення синтезованих поліпептидних ланцюгів від рибосоми. Фактор RFi реагує на появу УАГ і УАА; RF2 — на кодони УАА і УГА.
У евкаріотів термінація відбувається з участю лише одного, фактора — RF, для дії якого необхідна ГТФ.
Процес термінації складається з кількох етапів. Спочатку поліпептидний ланцюг з A-ділянки рибосоми, де утворюється останній пептидний зв’язок, переміщується в П-ділянку. Потім відбувається розрив складноефірного зв’язку між С-кінцевою амінокислотою та її тРНК, і білок залишає рибосому. Комплекс рибосома -іРНК-тРНК розпадається. Рибосома дисоціює на субодиниці. Звільнені рибонуклеїнові кислоти, очевидно, можуть використовуватись в наступних циклах синтезу білка. Цей процес досить складний і до кінця ще не вивчений.
Підраховано, що синтез типового білка, який складається приблизно з 150—200 амінокислотних залишків, на рибосомах триває 1—3 хв. Отже, кожний цикл роботи рибосоми, що забезпечує видовження поліпептидного ланцюга білка на один амінокислотний залишок, триває долі секунди. З’ясування основних етапів синтезу білка є значним досягненням біології на молекулярному рівні. Експериментально встановлена генетична роль нуклеїнових кислот, розкрита суть генетичного коду, що грунтується на молекулярній структурі ДНК, і ним самим конкретизована природа мутацій — основа еволюції і мінливості живих систем.
Молекулярні механізми специфічності біосинтезу білків.
Генетичний код
Як уже зазначалось, синтез білка відбувається на рибосомах ферментативним шляхом відповідно до інформації, закладеної в структурі ДНК. Саме ДНК є матрицею, штампом, в якому запрограмовано відповідну первинну структуру білка, який синтезується.
Виникає питання, яким чином послідовність чотирьох різних нуклеотидів, які становлять структуру нуклеїнових кислот, визначає послідовність 20 амінокислотних залишків в білку. Як було розшифровано код білкового синтезу?
Використовуючи 4-буквений алфавіт азотистих основ, можна скласти 4 однобуквених слова — сіглетний код, 16 двобуквених (4-4=16) —дублетний код або 64 трибуквених слова (4-4-4 = 64)—триплетний код (кодон). Для 20 амінокислот 16 двобуквених слів мало, а — 64 трибуквених — достатньо.
У 1954 р. було запропоновано кодове слово з трьох азотистих основ — триплетний код. Проте треба було вивчити, які нуклеотиди і в якому порядку в молекулі ДНК (іРНК) відповідають різним амінокислотам. Ці дослідження провели М. Ніренберг і Г. Корана, за що вони удостоєні Нобелівської премії.
Учені добули синтетичний РНК-полімер — поліуридилову кислоту. Добуту РНК добавляли до системи, де відбувався синтез білка. При цьому відбувався синтез полі- фенілаланіну, а інші 19 амінокислот не включалися в по- лінуклеотидний ланцюг. Таким чином було доведено, що три уридилових залишки (УУУ) кодують включення в поліпептидний ланцюг молекули білка амінокислоти фенілаланіну. Згодом було з’ясовано склад кодонів для всіх інших амінокислот. Наприклад, якщо в структурі нуклеїнової кислоти зустрічається кодон ГГГ, то він забезпечує включення в поліпептидний ланцюг глутамінової кислоти, ААА — лізину, ЦЦЦ — проліну та ін. (табл. 8).
З наведених у таблиці 8 даних видно, що амінокислоти мають по кілька кодонів. Необхідно наголосити, що з 64 кодонів 61 визначає послідовність розміщення амінокислотних залишків у поліпептидному ланцюгу, при цьому кодон ГУГ (валіновий), АУГ (метіоніновий) є також ініціаторними, стартовими кодонами. Три інших кодони — УАГ, УАА, УГА — називають беззмістовними, вони виконують функцію сигналів про закінчення синтезу поліпептидного ланцюга.
Таблиця 8. Генетичний код
Перший нуклеотид |
Другий нуклеотид |
Третій нуклеотид |
|||
У |
Ц |
А |
Г |
||
У |
Фен |
Сер |
Тир |
Цис |
У |
Фен |
Сер |
Тир |
Цис |
Ц |
|
Лей |
Сер |
А |
|||
Лей |
Сер |
Три |
Г |
||
Лей |
Про |
Гіс |
Apr |
Ц |
|
Ц |
Лей |
Про |
Гіс |
Apr |
Ц |
Лей |
Про |
Глу |
Apr |
А |
|
Лей |
Про |
Глу |
Apr |
Г |
|
Іле |
Тре |
Аси |
Cep |
У |
|
Іле |
Тре |
Асп |
Cep |
Ц |
|
А |
Іле |
Тре |
Ліз |
Apr |
А |
Мет |
Тре |
Ліз |
Apr |
Г |
|
Вал |
Ала |
Асп |
Глу |
У |
|
Вал |
Ала |
Асп |
Глу |
Ц |
|
Г |
Вал |
Ала |
Глу |
Глу |
А |
Вал |
Ала |
Глу |
Глу |
Г |
|
Аналізуючи таблицю генетичного коду, можна помітити, що перші два нуклеотиди в кодоні важливіші, ніж третій. Деякі дослідники вважають, що заміна третього нуклеотиду в значній частині кодонів не впливає на їх здатність кодувати відповідну амінокислоту. Наприклад, аланін кодується такими нуклеотидами: ГЦУ, ГЦЦ, ГЦА, ГЦГ, які відрізняються між собою третім нуклеотидом.
Враховуючи, що перші два нуклеотиди в триплетах мають високу специфічність, англійський фізик Ф. Крік у 1965 р. розробив теорію неоднозначної відповідності, що в точному перекладі означає коливання. З неї випливає, що основна значений при пізнанні кодону антикодоном ма* ють перші два нуклеотиди. Вони повністю підпорядковані комплементарному принципу взаємодії азотистих основ. Що стосується третього нуклеотиду кодону, то він неоднозначно може вступати у взаємодію більше ніж з одним типом нуклеотидів антикодону. Усе це сприяє підвищенню стійкості генетичної інформації при пошкодженні ДНК.
Деякі особливості генетичного коду. Необхідно зазначити, що генетичний код, очевидно, є універсальним. Він однаковий для всіх організмів — бактерій, рослин і тварин. Правда, деякі організми віддають перевагу одним триплетам, інші — іншим триплетам. Універсальність коду свідчить про те, що він з’явився на ранніх етапах розвитку живих систем і, очевидно, дуже мало змінюється в ході еволюції.
Характерною особливістю коду є його виродженість. Про це свідчить той факт, що два й більше триплетів можуть кодувати одну амінокислоту. Проте код не є неоднозначним. Жодний кодон, крім ініціаторних (ГУГ і АГУ), не кодують більше ніж одну амінокислоту.
У більшості випадків виродженість коду зумовлює наявність кількох тРНК для однієї амінокислоти, які відрізняються між собою антикодонами.
Однією з особливостей коду є те, що він не перекривається, тобто нуклеотиди, які входять у даний триплет, не беруть участі у формуванні наступних триплетів. Після зчитування інформації з одного триплету механізм зчитування пересувається зразу на всі три нуклеотиди.
Характерною особливістю коду є також його неперервність. Кожний триплет, який кодує відповідну амінокислоту, перебуває у сусідстві з іншим триплетом, без проміжних розділяючих ділянок (факторів).
Досить важливою особливістю коду є його односпрямо- ваність. Кодони при синтезі білка транслюються в одному напрямі, починаючи з першої нуклеотидної основи. Перша азотиста основа міститься біля 5'-нуклеотидного кінця, а остання біля 3'-кінця, тобто зняття інформації відбувається в напрямі 5'→3'.
В останні роки з’явились дані, які свідчать про окремі відхилення від загальноприйнятих особливостей генетичного коду. Так, вивчаючи нуклеотидну послідовність ДНК мітохондрій людини, встановили, що в цілому в них генетичний код подібний до раніше відомого. Водночас виявлено, що чотири кодони змінили свій зміст. Кодон УГА відповідає триптофану, кодон АУА — метіоніну, а кодоми — АГА і АГГ стали термінуючими. У мітохондріях дріжджів усі чотири лейцинових кодони, які починаються з ЦУ, перейшли до треоніну. Таким чином, у лейцину залишилось лише два кодони, а в треоніну стало шість кодонів. Отже, в одній клітині організму людини виявлено існування двох різних кодів. Добуті дані, очевидно, є доказом того, що код піддавався певним, незначним еволюційним змінам і універсальність коду має свої нюанси.
Піддається певним корективам і та особливість коду, що він не перекривається. У дослідах з вірусами і деякими бактеріями встановлено, що одна й та сама ділянка ДНК може кодувати кілька різних білків за принципом зміщення рамки зчитування. Так, якщо взяти будь-який код з певною послідовністю нуклеотидів, наприклад ТАГАТГЦГЦА, то при зчитуванні його з першої букви дістанемо триплети ТАГ, АТГ, ЦГЦ, а якщо зчитування почати з другої букви, дістанемо зовсім інші триплети — АГА, ТГЦ, ГЦА і т. д. Крім того, було встановлено, що для окремих білків частина послідовності нуклеотидів спільна. Так, коли для одного білка дана послідовність нуклеотидів закінчується, то для другого білка вона може ще продовжуватися. Ці дані свідчать, що транскрипція генетичного коду підпорядкована певним контрольним механізмам, які забезпечують вибір правильного коду.
Встановлено ряд нових фактів про те, що в генах евкаріотів є некодуючі ділянки, іншими словами, гени у вищих організмів не неперервні, а побудовані з окремих частин, які розділені іншими послідовностями нуклеотидів. Проміжки між відрізками генів бувають різними — від 10 до 20 000 пар нуклеотидів.
Регуляція білкового синтезу
Необхідною умовою існування живих систем, забезпечення основних проявів життєдіяльності є наявність узгодженої системи регулювання найважливіших процесів, які відбуваються в них. Це насамперед стосується білкового синтезу, оскільки оптимальне співвідношення між кількістю і якістю різних білків відіграє важливу роль у забезпеченні ряду життєво необхідних процесів як одноклітинних, так і багатоклітинних організмів. З участю білків- ферментів відбувається регуляція обміну речовин, адаптація до зміни умов зовнішнього і внутрішнього середовища, процеси онтогенезу та диференціації клітин, органів і систем. Тому досить важливим є здійснення контролю за синтезом саме тих білків-ферментів, які необхідні клітині в даних умовах, відповідно до виконуваних функцій. У процесі тривалого історичного розвитку живих організмів, незалежно від ступеня їх організації, сформувався досить складний, узгоджений механізм регулювання білкового синтезу, який забезпечує постійний якісний і кількісний склад білків.
З’ясування суті механізму регуляції білкового синтезу— досить складна проблема, яка ще не повністю розв’язана. Над розв’язанням цієї проблеми протягом кількох десятиріч працювала велика група радянських і зарубіжних дослідників-генетиків, біохіміків, біологів. Логічним розвитком цих важливих досліджень стала концепція регуляції білкового синтезу, яку розробили в 1961 р. лауреати Нобелівської премії, французькі вчені Ф. Жакоб і Ж- Моно.
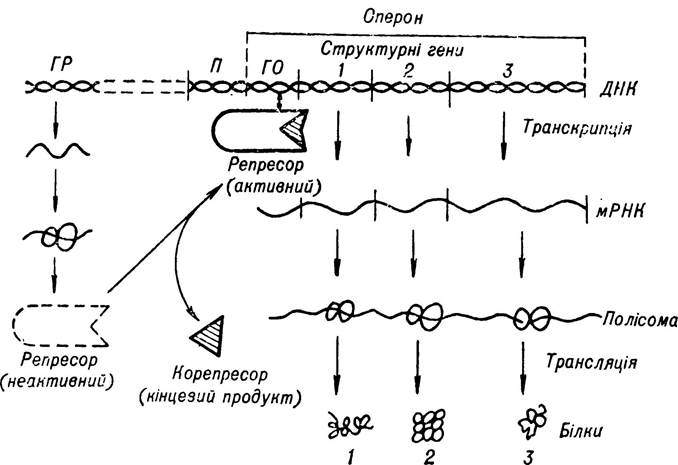
Концепція Ф. Жакоба і Ж- Моно дістала широке визнання і є нині загальноприйнятою. Згідно з цією концепцією регуляція білкового синтезу відбувається на рівні ДНК, молекула якої складається з певних функціональних ділянок — генів, згрупованих відповідно до виконуваних функцій. Одна група цих функціональних ділянок називається структурними генами, або цистронами, які містять інформацію про синтез певних поліпептидних ланцюгів білка. На них відбувається синтез молекули ІРНК, яка потім надходить на рибосоми, де вона виконує роль матриці в процесі білкового синтезу. Починається синтез іРНК — зчитування генетичної інформації — з функціональної ділянки ДНК, яка має назву промотора і є точкою ініціації її синтезу.
Іншу групу функціональних ділянок ДНК становлять регуляторні гени, які регулюють активність структурних генів включенням їх та виключенням. Регуляторні гени — ген-оператор, що безпосередньо прилягає до групи структурних генів, і ген-регулятор, що міститься від них на деякій відстані.
Гени-оператори є ніби пусковим механізмом, який залежно від умов дає змогу або гальмує синтез іРНК на структурних генах ДНК. Вважають, що ген-оператор локалізований на крайньому відрізку цистронів і є, очевидно, вихідним пунктом дії ДНК-залежної-РНК-полімерази.
Гени-оператори разом з групами структурних генів утворюють групи узгоджено діючих блоків-оперонів, кожен з яких відповідає за взаємозв’язаний синтез ряду специфічних білків, тобто оперон є одиницею транскрипції. Якщо ген-оператор не діє, то весь оперон стає бездіяльним —гальмується синтез іРНК, а отже, і білків-ферментів. Діяльність оператора регулюється геном-регулятором. Оскільки ген-регулятор і структурні гени оперону розміщені на різних ділянках ДНК, зв’язок між ними забезпечується з участю речовин посередників — білків-репресорів, утворення яких відбувається в рибосомах ядра на матриці специфічної мРНК, що синтезується на гені-регуляторі.
Свою назву білок-репресор дістав від того, що він гальмує (репресує) діяльність гена-оператора, тобто ставить ген-оператор в положення «виключено», внаслідок чого припиняється функціонування всієї групи структурних генів. Репресори мають спорідненість з оператором і здатність до зворотного зв’язування з ним. Крім того, репресор здатний до специфічного зв’язування з певними низькомолекулярними речовинами, що мають назву індукторів, або ефекторів.
За звичайних фізіологічних умов репресори можуть бути в активному і пасивному стані. Перехід з одного стану в інший регулюється продуктами внутріклітинного обміну або речовинами, що надходять із зовнішнього середовища.
Залежно від стану репресора, розрізняють індуцибельну і репресибельну системи генної регуляції білкового синтезу.
При індуцибельній системі регуляції репресор, що утворюється на гені-регуляторі, перебуває в активному стані. Його вплив на ген-оператор приводить до блокування діяльності оперона і припинення синтезу ІРНК та певних білків-ферментів. Синтез їх може бути відновлений лише в тому разі, коли в клітині з’являться продукти, для утилізації яких потрібні дані ферменти. Репресор сполучається з цими продуктами, що мають назву індукторів, і втрачає здатність контролювати ген-оператор, внаслідок чого відновлюється синтез іРНК.
Вважають, що індуктор, сполучаючись з білком-репресором, зумовлює зміну його третинної структури, внаслідок чого він втрачає здатність до зв’язування із субстратом — геном-регулятором. Водночас оператор, який виходить з-під контролю гена-регулятора стає активним і приводить в дію блок структурних генів, на яких здійснюється синтез ІРНК, необхідних для утворення певних ферментів. Оскільки ці ферменти спрямовані на утилізацію продукту (індуктора), репресор буде пасивним доти, доки під впливом ферментів не відбудеться повне розщеплення індуктора. Після цього репресор звільняється, переходить в активний стан і блокує оперон, внаслідок чого синтез ІРНК, що кодує первинну структуру даних ферментів, припиняється. На мал. 17 показано основні етапи індуцибельної системи регуляції білкового синтезу.
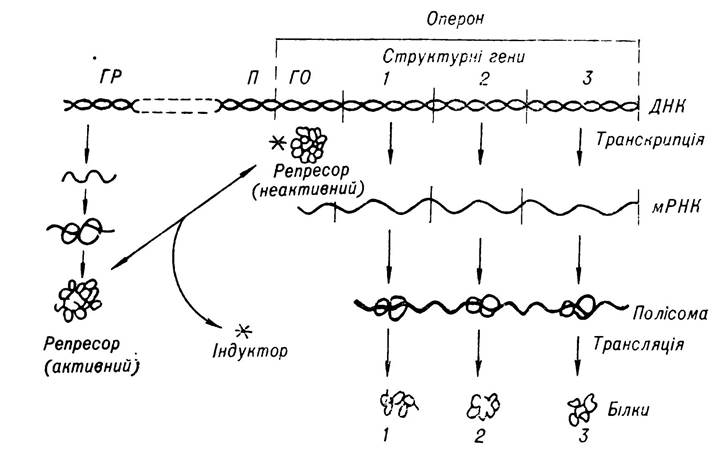
Мал. 17. Схема регуляції синтезу білка шляхом індукції (за Т. Т. Березовим і Б. Ф. Коровкіним).
ГР — ген-регулятор; П — промотор; ГО — ген-оиератор.
Прикладом індуцибельної регуляції білкового синтезу може бути синтез у клітинах кишкової палички ферменту галактозидази, який здійснює гідроліз молочного цукру (лактози) на глюкозу і галактозу. Штами бактерій, які ростуть на глюкозі, не можуть розвиватись, якщо їх помістити в середовище, що містить замість глюкози лактозу, до того часу, доки не синтез відповідних ферментів, здатних утилізувати даний субстрат і використовувати його як джерело енергії.
Лактоза, що потрапляє в середовище, виконує роль індуктора, який зв’язується з білком-репресором і блокує його зв’язок з геном-оператором. Оператор і структурні гени вивільняються і починають синтез ІРНК, яка кодує первинну структуру ферменту галактозидази і забезпечує синтез цього ферменту на рибосомах.
Крім індукції генів у клітинах спостерігається їх репресія. Особливо часто цей процес спостерігається при різних процесах синтезу, коли вміст ряду ферментів значно знижується із збільшенням вмісту кінцевих продуктів реакцій, що каталізуються цими ферментами. При репресибельній системі регуляції білкового синтезу репресор, що синтезується на рибосомах ядра, перебуває в пасивному стані і не може
пригнічувати діяльність гена-оператора, а отже, і не контролює діяльність оперона, на якому відбувається синтез ІРНК. Перехід регіресора в активний стан, блокування оперона й припинення синтезу ІРНК відбувається під впливом речовини корепресора. Як корепресор виступають кінцеві продукти реакції синтезу або один з цих продуктів. Є дані про те, що як корепресор у синтезі ферментів обміну амінокислот може виступати не вільна амінокислота (кінцевий продукт біосинтетичної реакції), а комплекс її з тРНК (аміноацил-тРНК).
Блокування гена-оператора припиняється тоді, коли вичерпується весь корепресор. Внаслідок цього у разі відсутності активатора (корепресора) репресор переходить у свій звичайний пасивний стан, вивільняє ген-оператор і групу структурних генів, на яких відновлюється синтез білків- ферментів. Нижче наведено схему репресибельної системи регуляції білкового синтезу (мал. 18).
Концепція Ф. Жакоба і Ж. Моно відносно регуляції білкового синтезу стосується нижчих організмів — прокаріотів. Механізм регуляції цих процесів у клітинах високоорганізованих організмів — евкаріотів значно складніший. Певний внесок у розв’язання цієї проблеми зробив радянський учений Г. П. Георгієв. Відповідно до його гіпотези в клітинах вищих організмів гени також згруповані в оперони, але їхній склад не такий простий, як у мікроорганізмів. Основна відмінність полягає в тому, що оперон має ряд генів-операторів, і кожний з них реагує з іншим репресором. Блокування будь-якого оператора перешкоджає просуванню ферменту ДНК-залежної-РНК-полімерази. Як результат цього синтез іРНК на структурних генах уповільнюється або зовсім припиняється.
Мал. 18. Схема регуляції синтезу білка репресією (за Т. Т. Березовим і Б. Ф. Коровкіним).
Буквені позначення ті самі, що й на мал. 17.
Оскільки є кілька операторів, то на активність оперона впливають різні фактори. Наприклад, один оператор може блокуватися з підвищенням вмісту певного гормона, інший — коли нагромаджується в клітині певний продукт обміну і т. д. Крім того, один і той самий ген-оператор входить до складу різних оперонів. Тому ці оперони реагують на один і той самий фактор. Це свідчить про те, що один будь-який фактор може регулювати відразу кілька оперонів, а активність одного оперона може залежати від ряду різних факторів. Це створює досить точну і водночас гнучку систему саморегуляції.
Слід зазначити, що в механізмах, які зумовлюють специфічність біосинтезу білків, а також в регуляції білкового синтезу ще не все з’ясовано.
Генна інженерія і біосинтез білка
Успішне проведення досліджень у галузі генної інженерії має, крім теоретичного, важливе практичне значення, зокрема для розв’язання проблеми біологічного синтезу цілого ряду важливих білків. За допомогою певних методів (синтезу на іРНК з участю ревертази або звичайним хімічним синтезом) добувають ген, який визначає синтез відповідного білка. Потім такий ген вбудовується у відповідну систему, яка дає можливість йому швидко розмножуватися. У вигляді такої системи, яку часто називають вектором, використовують плазміди — автономні структури, що несуть свою інформацію у вигляді невеликої циклічної молекули ДНК. Вони виявлені в бактеріальних клітинах разом з бактеріальною хромосомою. Крім плазмід, можуть використовуватись і інші системи — віруси, фаги тощо.
Плазміди, що містять вбудований ген (рекомбінантні ДНК), вводять в бактеріальні клітини, які завдяки цьому набувають здатності синтезувати нові для них речовини.
До групи таких важливих білків можна віднести гормон інсулін. Недостача інсуліну в організмі людини призводить до такого тяжкого і досить поширеного захворювання, як діабет. Для його лікування використовують інсулін тварин ного походження, добутий з підшлункової залози великої рогатої худоби або свиней.
Проте з’ясувалось, що для деяких людей він не ефективний або зумовлює алергію. Це пояснюється тим, що між інсуліном людини і тварин є певна структурна відмінність. Отже, виникла потреба у виробництві інсуліну людини. Добувати його синтетично економічно невигідно.
Генна інженерія дала більш рентабельний спосіб синтезу інсуліну. Добуто штами бактерій з рекомбінантними ДНК, які виробляють проінсулін людини. З нього потім легко вже добути інсулін. Тепер питання промислового виробництва інсуліну розв’язане, препарат проходить клінічне випробування.
Другим важливим об’єктом генної інженерії є інтерферон — універсальний противірусний препарат. В його основі лежить білок, що виробляється клітинами організму як відповідна реакція на вірусну інфекцію. Вивчення властивостей інтерферону показало, що він має високу видову специфічність. Тому для лікування людини може використовуватись інтерферон лише людини.
Зараз інтерферон добувають головним чином з лейкоцитів донорської крові. Однак такий спосіб добування інтерферону досить дорогий і, крім того, не може повністю забезпечити потребу в ньому. Тому інтенсивно ведуться роботи по розробці нових способів добування інтерферону, зокрема за допомогою генної інженерії. Програма добування штаму—продуцента інтерферону успішно завершена, що дасть можливість найближчим часом виробляти препарат у достатній кількості.
Недавно за допомогою генної інженерії добуто ще один важливий білок — соматотропін. Це гормон росту людини, який містить 131 амінокислотний залишок. Соматотропін застосовують при лікуванні карликовості, переломах кісток, опіках та при цілому ряді інших захворювань.
Отже, генна інженерія відкриває нову технологію (біотехнологію) синтезу важливих для організму речовин, зокрема білків. Це дає можливість значно знизити вартість і розширити асортимент виробництва гормонів, ферментів та інших білкових препаратів, які використовуються в медицині та сільському господарстві, відповідно до завдань, поставлених XXVI з’їздом КПРС в Основних напрямах економічного і соціального розвитку СРСР на 1981—1985 роки і на період до 1990 року.
Збільшення виробництва білка — проблема глобального значення
Нині важливого значення набуває проблема забезпечення населення планети повноцінними продуктами харчування, і насамперед такими важливими компонентами харчового раціону, як білки. У багатьох країнах світу спостерігається недостача кормових білків, а потреба в тваринних білках задовольняється в середньому лише на 40—50 %. Особливо гостро відчувається білкове голодування в економічно відсталих країнах і в країнах, що розвиваються.
Крім того, не вистачає й кормового білка для потреб тваринництва.
У зв’язку з дальшим ростом населення, скороченням посівних площ із-за урбанізації, індустріалізації, забрудненням океану та ряду інших причин, дефіцит білка зростатиме. Тому пошуки нових способів і методів збільшення виробництва білкових речовин є однією з найважливіших проблем глобального значення. У цьому плані перспективними є індустріальні методи виробництва білків, що грунтуються на культивуванні нижчих організмів — дріжджів, бактерій, грибів, водоростей на нехарчових сировинних джерелах. Ці методи мають найбільший потенціал з усіх способів розв’язування білкової проблеми.
Перспективність виробництва білка з участю одноклітинних організмів визначається високою швидкістю подвоєння їх біомаси порівняно з рослинами або тваринами і високим вмістом у ній білка. Відомі бактерії, які мають здатність подвоювати кількість своїх клітин за кожні 5—8 хв, а вміст білка в біомасі може досягати до 70 %.
Разом з цим мікроорганізми можна вирощувати рівномірно в усі пори року, при цьому не буває неурожайних років, не страшні поширення епізоотій і захворювань рослин та ін. Мікробіологічні виробництва потребують невеликих площ і ефективно використовують добрива і воду. Мікроорганізми добре адаптуються до нових умов середовища і склад їх біомаси легко піддається технологічному і селекційному контролю. Досить важливим є також те, що при правильній організації мікробіологічне виробництво білка не наносить шкоди природним біоценозам.
Для мікробіологічних виробництв найчастіше використовуються різні види дріжджів. З давніх-давен хліб, вино виробляли з використанням саме цих організмів. У перших сучасних великотоннажних виробництвах для добування білка одноклітинних організмів як в нашій країні, так і за кордоном, були використані дріжджі. Перевагою цих мікроорганізмів перед іншими є їх висока стійкість проти інфекцій, здатність легко відділятися від середовища завдяки великим розмірам клітин, здатність рости на відносно простих середовищах і легко асимілювати різні джерела вуглецю й азоту. Крім того, біомаса, яку дістають з участю дріжджів, має високі харчові якості і приємний аромат.
Останнім часом спостерігається тенденція до розширення набору таксономічних груп мікроорганізмів, які використовуються для виробництва білка. Так. з цією метою почали використовувати різні види бактерій. Це зумовлено насамперед тим, що бактеріальні штами характеризуються високою швидкістю росту і вищим, ніж в інших організмів, вмістом білка й метіоніну в біомасі.
Для добування білкової маси застосовують також промислове вирощування грибів як нижчих (Penicillium), так і вищих. Перевагою грибів перед іншими організмами є легкість виділення біомаси, здатність деяких з них засвоювати лігнін, а також невисокий вміст в їх біомасі нуклеїнових кислот — 1,5—2,8 %.
Для добування білка використовують і водорості. Біомаса їх характеризується високим вмістом (до 70 %) і біологічною цінністю білка. Водорості можна вирощувати, як і вищі рослини, фотосинтетично. Порівняно з рослинами водорості містять більше сухої речовини і білка. Однак створення умов для фотосинтетичного вирощування водоростей пов’язано із забезпеченням їх оксидом вуглецю (IV) і світлом, технікою для перемішування біомаси та ін. Усе це потребує відносно значних капіталовкладень. Тому поки що більш економічно вигідно вирощувати гетеротрофні організми на різних вуглецевовмісних середовищах.
Нині в природі вивчена лише незначна кількість мікроорганізмів, що використовуються для добування білка. У літературі дедалі частіше з’являються дані про нові культури, які мають здатність інтенсивно синтезувати білок та використовувати специфічні субстрати.
Необхідно зазначити, що природні запаси сировини для здійснення мікробіологічних процесів досить великі, оскільки мікроорганізми можуть використовувати більшість природних сполук вуглецю. Але щоб процес був економним, сировина має бути дешевою, доступною і в необхідній кількості.
На перших етапах виробництво білка одноклітинних організмів здійснювалось лише з відходів окремих, головним чином харчових, виробництв.
У кінці минулого століття стали відомі мікроорганізми, які можуть розвиватися на вуглеводнях нафти. Значні дослідження в цій галузі проводив радянський учений В. О. Таусон на початку XX ст. Та лише в 60-х роках було доведено, що ця сировина має потенціальне промислове значення. Так, 2 % всієї кількості нафти, яка добувається в світі, достатньо для виробництва 25—30 млн. тонн дріжджового білка. Такою кількістю білка можна забезпечити повноцінне харчування протягом усього року 2 млрд. людей.
Для мікробіологічного синтезу білка часто використовуються дріжджі Candida guillermondii. Вони добре ростуть і розмножуються на нормальних алканах, що’ мають довжину вуглецевого ланцюга від С11 до С24. Дослідження кінетики використання цих вуглеводнів мікроорганізмами показало, що вони найлегше засвоюють нормальні алкани, які мають склад С11—С14. Вуглеводні з довжиною вуглецевого ланцюга С15—С18 займають середнє положення, а більш високомолекулярні вуглеводні асимілюються важче. Наукові основи мікробіологічного добування білкових речовин із вуглеводнів нафти розроблені групою радянських учених на чолі з академіками М. Д. єрусалимським і Г. К. Скрябіним, за що вони були удостоєні Державної премії СРСР.
Завдяки використанню очищених вуглеводнів мікроорганізмами можна добути кормовий продукт без стадії очищення біомаси.
Для культивування мікроорганізмів використовують і неочищену нафтову сировину, наприклад нафтові дистиляти. За таких умов добута біомаса піддається детальному очищенню.
В останні роки в нашій країні і за кордоном розроблено технологію мікробіологічного синтезу білка на газоподібних вуглеводнях. Завдяки леткості невикористані вуглеводні легко видаляються з біомаси.
Нині добувають білок мікроорганізмів, які вирощують на спиртах (метанолі, етанолі), органічних кислотах, кетонах, альдегідах, ефірах та інших сполуках, умовно об’єднаних під назвою «окислені вуглеводні», або оксидати. На думку дослідників, найбільш вдалою сировиною для вирощування мікроорганізмів є спирти, які добре розчинні у воді і легко вимиваються з готового продукту.
Останнім часом значну увагу вчених привертають практично необмежені джерела клітковиновмісних субстратів. Щорічний світовий приріст рослинної біомаси становить 155 млрд. тонн. При обробці частини цієї біомаси утворюються сотні мільйонів тонн відходів. Наприклад, при переробці деревини на клітковину для виготовлення паперу використовується лише 50 % сировини. Є значна кількість іншої рослинної нехарчової сировини — рисове, соняшникове, гречане лушпиння, обрізки виноградної лози, стебла і кошики соняшників, солома та ін. Розкладання їх внаслідок гідролізу приводить до утворення простих цукрів — моноз. Такі гідролізати використовуються для мікробіологічного синтезу білка. Нині проводяться дослідження по виявленню мікроорганізмів, які можуть інтенсивно нагромаджувати біомасу при використанні гідролізатів клітковини та інших складних вуглеводів.
Оскільки запаси органічних речовин не безмежні, то важливого значення набуває розробка основ технології добування білка з участю автотрофних бактерій, які не потребують для свого розвитку органічних сполук. Щодо цього перспективними є фотосинтезуючі мікроорганізми.
Доведено, що дріжджі, бактерії і водорості можуть бути корисним джерелом білка, вітамінів і мінеральних речовин для людини. Проте кількість нуклеїнових кислот, яка вводиться разом з білком одноклітинних організмів в дієту, не повинна перевищувати 2 г на добу. Наявність більшої кількості цих кислот в їжі людини може стати однією з причин захворювання поліартритом та утворення солей сечової кислоти в сечовивідних каналах. Щоб знизити кількість нуклеїнових кислот у біомасі, її обробляють лугами, певними ферментами, вдаються до активування внутріклітинних нуклеаз, що зумовлює руйнування нуклеїнових кислот до низькомолекулярних продуктів, які в разі потреби можна легко видалити з біомаси.
У багатьох країнах світу білок одноклітинних організмів використовується для збагачення цілого ряду харчових продуктів — ковбас, сиру, хліба, консервів тощо. Наприклад, біохіміки ПНР розробили технологію добування продуктів, які містять в своєму складі 3—5 % сухих харчових дріжджів. В УНР запропоновано мікробіологічний метод виробництва харчового білка, який за своєю біологічною цінністю близький до курячого м’яса. У Швейцарії з білка організмів одноклітинних після надання йому певної структури виготовляють замінник м’яса, а в Японії мікробний білок широко використовують для виготовлення різних харчових приправ.
Необхідно наголосити, що, крім мікробіологічного виробництва білка, використовуються й деякі інші способи виділення білків з нехарчової рослинної сировини — листя дерев, неїстівного зерна, бобів тощо. Вважають, що найбільші резерви білка є в листі. Вміст його на 1 га в рік становить від 2 до 5 тонн. Проте вилучення білків з листя потребує високих затрат енергії. В СРСР проводяться роботи по виділенню білка з насіння бавовника.
Важливе значення для розв’язання проблеми харчового білка має виробництво протеїногенних амінокислот, особливо незамінних (див. с. 51). Добавляння їх до рослинних білків, які характеризуються низьким вмістом незамінних амінокислот, значно підвищує їх біологічну цінність. Так, після добавляння 0,4 % лізину до пшеничного борошна його біологічна цінність підвищується не менш як на 50 %. У птахівництві і свинарстві соєве борошно, що входить до складу кормів, збагачують метіоніном. Це сприяє кращому засвоєнню білків, позитивно впливає на підвищення продуктивності тваринництва.
Якщо до раціонів з недостатнім вмістом протеїну добавити амінокислот, то ріст поросят прискориться на 20— 25 %, а при нормальному його вмісті — на 10—15 % порівняно з контрольними. За цих умов знижується витрата кормів і протеїну на одиницю продукції. Проведені розрахунки показують, що добавляння 1 кг амінокислоти лізину на тонну комбікормів дає можливість додатково одержати 60 кг свинини або м’яса птиці і зекономити до 180 кг кормів.
Отже, можна зазначити, що нині людство вступило в еру індустріального виробництва білка — найбільш важливого і дефіцитного харчового продукту. Успіхи в цій галузі сприятимуть забезпеченню населення Землі достатньою кількістю білка в їжі, а також підвищенню його вмісту в раціонах тварин.