БІОХІМІЯ ДЛЯ ВЧИТЕЛЯ - Ф.Ф. БОЄЧКО - 1985
ОСНОВНІ ХІМІЧНІ КОМПОНЕНТИ КЛІТИН
ФЕРМЕНТИ - КАТАЛІЗАТОРИ ЖИТТЄВИХ ПРОЦЕСІВ
Однією з основних характерних ознак живих систем є обмін речовин, який постійно забезпечує їх самооновлення. Процеси обміну відбуваються в організмі лише завдяки наявності в ньому специфічних білкових речовин — ферментів, які виконують функцію біокаталізаторів.
Ферменти широко розповсюджені в природі. Вони утворюються в живих клітинах і за їх допомогою відбуваються складні, необхідні для розвитку, росту і розмноження фізіологічні та біохімічні процеси.
Без ферментів організми не могли б використовувати харчові продукти, здійснювати розщеплення і синтез основних їх компонентів — білків, жирів і вуглеводів. Розщеплення цих речовин поза організмом відбувається лише внаслідок кип’ятіння їх з мінеральними кислотами. В організмі ці процеси протікають з високою швидкістю і в значно м’якших умовах — зокрема, при температурі тіла організму.
Слід зазначити, що ферменти діють і за межами живого організму. їх можна виділити в чистому кристалічному стані без втрати властивостей, каталітичної активності та білкової структури.
Люди використовують ферменти в своїй практичній діяльності з давніх-давен. У наш час не тільки відкрито багато ферментів, досліджено їх білкову природу, встановлено оптимальні умови їх каталітичної дії, а й створено таку галузь науки, як ензимологія. Розкрито механізм дії значної кількості ферментів, розроблено технологію промислового виробництва цілого ряду ферментних препаратів і способи використання їх у різних галузях народного господарства і практичній медицині.
Ферменти — також білки
Вивчення хімічного складу ферментів дало можливість встановити, що всі вони є білковими речовинами. Ферменти, як і білки, у розчинах перебувають в колоїдному стані, проявляють амфотерні властивості, інактивуються при дії високих температур, піддаються гідролітичному розщепленню з участю протеолітичних ферментів, мають високу відносну молекулярну масу і багато інших ознак, спільних з білками.
Усі відомі ферменти поділяють на дві великі групи: прості ферменти (ферменти-протеїни) і складні (ферменти-протеїди).
Молекули простих ферментів складаються лише з білка. За хімічними властивостями вони належать до альбумінів (естераза печінки), глобулінів (трипсин і уреаза) і цілого ряду інших груп простих білків. Простими ферментами є також гідролази шлунково-кишкового тракту, зокрема трипсин, хімотрипсин, РНК-аза, ДНК-аза та ін.
Складні ферменти складаються з простого білка і не- білкової частини. Білкову частину ферментів-протеїдів часто називають апоферментом, а небілкову — простетичною групою, якщо вона міцно і постійно зв’язана з білковою частиною, або коферментом (коензимом), якщо небілкова частина слабо зв’язана з білком і може легко відокремлюватись.
Прикладом ферментів, в яких білкова частина постійно і міцно зв’язана з небілковою, можуть бути каталаза і пероксидаза. У такій групі ферментів, як дегідрогенази (глюкозо-6-фосфатдегідрогеназа, алкогольдегідрогеназа), небілкова частина виступає у вигляді типового коферменту.
Численні дослідження показали, що роль небілкової частини у ферментах-протеїдах виконують ряд вітамінів та їх похідних, пептиди, нуклеотиди, металовмісні комплекси, атоми заліза, міді.
Розглядаючи хімічну природу ферментів-протеїдів, слід підкреслити, що білкова і небілкова частини окремо не виявляють належної ферментативної активності. Така активність спостерігається тільки тоді, коли білкова частина з’єднана з небілковою. Вважають, що небілкова група підвищує стійкість білкової частини, а остання зумовлює специфічність каталітичної дії ферменту. Небілкова частина, приєднуючись до різних білків, може каталізувати зовсім інші процеси.
Активний центр ферментів та механізм їх каталітичної дії
Дослідження ролі різних функціональних груп для каталітичної дії ферментів показало, що вона зв’язана не з усією молекулою ферменту, а лише з певною його ділянкою, яка називається активним, або каталітичним, центром.
У простих ферментах активний центр утворюється з амінокислотних залишків. Сюди належать залишки амінокислот цистеїну, серину, аргініну, аспарагінової та глутамінової кислот, гістидину, тирозину і триптофану. Серед них особливо важливе значення мають HS-групи цистеїну, НO-групи серину, імідазольне кільце гістидину, дещо менше значення мають карбоксильні групи аспарагінової та глутамінової кислот, а також індольна група триптофану. Характерним є те, що залишки амінокислот активного центру розміщені на різній відстані один від одного в поліпептидному ланцюгу ферменту. їх зближення з утворенням активного центру настає тільки внаслідок формування властивої для ферменту структури. Тому певні зміни в структурі ферменту супроводжуються завжди зміною його каталітичної активності. Наприклад, при денатурації, коли деформується структура білків, ферменти різко знижують або повністю втрачають каталітичні властивості. Амінокислотні залишки, що входять в активний центр, іноді поділяють на три види.
Перший з них має групи, які діють на субстрат в процесі каталізу, другий — групи, що здійснюють контакт між ферментом і субстратом. Третій вид амінокислот має групи, що виконують суто структурну функцію — вони відповідають за підтримання ферментом відповідної просторової структури. Окремі ферменти мають не один, а два й більше активних центри.
У ферментах-протеїдах активний центр представлений небілковою групою і залишками амінокислот, що прилягають до неї.
Крім активного центру, у ферментах розрізняють ще два центри — субстратний і алостеричний.
Вважають, що субстратний центр являє собою ділянку молекули ферменту, яка відповідає за приєднання речовини (субстрату), що повинна піддаватися перетворенню. Субстратний центр можна порівняти з якорем, на який стає корабель-субстрат, тому його часто й називають якорним майданчиком. Вивчення процесу взаємодії субстрату із субстратним центром показало, що вона відбувається за рахунок аміногрупи залишку амінокислоти лізину або карбоксильної групи залишку глутамінової кислоти субстрату. Субстрат із субстратним центром може з’єднуватися також за рахунок сульфгідрильної групи амінокислоти цистеїну. Це є свідченням того, що природа субстратного центру у різних ферментів, очевидно, різна.
Алостеричний центр — це ділянка молекули ферменту, яка під час приєднання до неї низькомолекулярної сполуки зумовлює зміну просторової (третинної) структури ферменту. Це в свою чергу призводить до зміни конфігурації активного центру, що веде за собою зміну каталітичної активності, тобто підвищує або знижує активність ферменту. Цей процес лежить в основі так званої алостеричної регуляції ферментативної активності. Проте поняття про активний, субстратний та алостеричний центри не можна абсолютизувати. У ферментах субстратний центр може збігатись з активним центром, а зміни в третинній структурі білкової молекули ферменту можуть виникати не тільки при дії на алостеричний центр, а і в момент приєднання субстрату до субстратного центру. Функції субстратного та алостеричного центрів дуже тісно пов’язані і взаємно переплітаються між собою.
Важливою проблемою ензимології є вивчення механізму дії ферментів. Ферменти — це особливі каталізатори, які з високою швидкістю здійснюють такі хімічні реакції, які досить важко провести в лабораторних умовах. Тому механізм їх дії становить значний інтерес як для хіміків, так і для біологів.
В основі існуючих теорій, що пояснюють механізм дії ферментів, лежить той факт, що ферменти значно знижують енергію активації відповідних реакцій, тобто енергію, яку необхідно затратити, щоб відбулася певна реакція. Для підтвердження цього можна навести такі приклади. Енергія активації розкладання пероксиду водню на кисень і воду без каталізатора становить 75,6 кДж/моль (Fi), при каталітичній дії колоїдної платини — 49,1 кДж/моль (F2), а при дії ферменту каталази — 21,1 кДж/моль (F3). З наведених даних видно, що ферменти знижують енергію активації, причому ферменти знижують її більше, ніж неорганічні каталізатори, що свідчить про вищу ефективність дії ферментів. Більшість дослідників вважає, що каталітична дія ферментів здійснюється з утворенням фермент-субстрат- них комплексів. Встановлено, що цей процес відбувається кількома етапами. На першому етапі ферментативного каталізу відбувається з’єднання субстрату з ферментом, на другому — активація і видозмінення субстрату з утворенням одного або кількох активованих комплексів і на останньому етапі — відділення продуктів реакції від ферменту. Схематично ці етапи можна показати так:
![]()
де Е — фермент, S — субстрат, ES — первинний фермент- субстратний комплекс; ES* — активований комплекс; Р — продукт реакції.
Слід зазначити, що найшвидше реакція відбувається на першому етапі.
Властивості ферментів
Властивості ферментів випливають з їх білкової природи. Крім того, для ферментів, як біологічних каталізаторів, характерні й певні специфічні ознаки. До них можна віднести термолабільність ферментів, вплив на їх активність pH середовища, специфічність дії ферментів тощо.
Ферменти дуже чутливі до зміни температури, тобто вони є термолабільними речовинами. Ферментативні процеси (на відміну від інших хімічних реакцій) не можуть відбуватися при температурі, вищій за 70—80 °С. При високій температурі руйнуються структура та активний центр ферменту, що призводить до втрати його каталітичної активності. При температурах, нижчих за нуль, вони також втрачають ферментативну активність, але не руйнуються. Тому коли низька температура перестає діяти, ферменти відновлюють свою активність.
Для ферментів існує певний температурний оптимум, тобто температура, при якій вони виявляють свою максимальну активність. Температурний оптимум для більшості ферментів, виділених з тваринних організмів, лежить в межах 35—45 °С. До цієї межі з підвищенням температури на 10 °С швидкість ферментативних реакцій зростає приблизно в два рази. Вище за температурний оптимум каталітична активність ферментів зменшується, а при температурі, яка зумовлює денатурацію білка, зовсім припиняється.
Є окремі ферменти, які характеризуються високою термостійкістю. До них можна віднести папаїн, міокіназу, трипсин та ін.
Вплив pH на активність ферментів. Активність ферментів дуже чутлива до зміни pH середовища. Для кожного ферменту або групи ферментів існує оптимальне значення pHсередовища, в якому вони максимально активні. Наприклад, фермент шлункового соку пепсин діє найкраще в кислому середовищі (pH 1,5—2,5), а трипсин, який є в дванадцятипалій кишці, максимально активний при pH 7—8. Більшість ферментів виявляє максимальну активність в слабкокислому, нейтріальному або слабколужному середовищі. Зниження або підвищення значення pH середовища, порівняно з оптимальним, супроводжується зменшенням активності ферменту. Це пов’язано з тим, що функціональні групи ферменту, які взаємодіють із субстратом, несуть певний заряд лише при відповідному значенні pH середовища, яке визначається як оптимальне. Зміна реакції середовища призводить до перезарядження функціональних груп, що виключає можливість ферменту взаємодіяти із субстратом. Крім того, концентрація водневих іонів впливає на іонізацію субстрату, фермент-субстратного комплексу і продуктів реакції.
Специфічність дії ферментів. Однією з основних властивостей ферментів, на відміну від інших каталізаторів, є їх висока специфічність. Це видно з того, що кожний фермент може каталізувати лише одну або кілька близьких за природою хімічних реакцій. Специфічність грунтується на повній відповідності структури субстрату і активного центру ферменту. За образним висловлюванням Е. Фішера, фермент повинен підходити до субстрату, як ключ до замка.
Розрізняють такі типи специфічності: абсолютну, абсолютну групову, відносну групову і стереохімічну, або оптичну.
Абсолютна специфічність характерна для ферментів, які діють лише на один точно визначений субстрат. Прикладом таких ферментів можуть бути уреаза, аргіназа та ін. Так, уреаза каталізує гідролітичне розщеплення сечовини на аміак і вуглекислий газ:
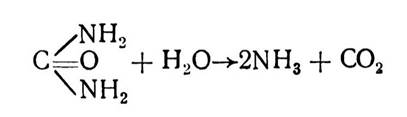
Достатньо замінити один атом водню в амінній групі на метильний радикал або добути будь-яке інше похідне сечовини, як уреаза перестане діяти на таку сполуку.
Абсолютна групова специфічність полягає в тому, що фермент може діяти на ряд близьких субстратів, які побудовані за одним принципом. Тут важливе значення має не тільки вид зв’язку, а й хімічна природа та структура радикалів, що прилягають до нього. Прикладом таких ферментів можуть бути карбоксипептидази і глюкозидази.
Відносна групова специфічність спостерігається тоді, коли фермент діє на різні субстрати з однаковим видом зв’язку. До таких ферментів належать протеолітичні ферменти — пепсин, трипсин і хімотрипсин, які каталізують гідролітичне розщеплення пептидних зв’язків у різних білків. Відносну специфічність мають естерази та інші ферменти.
Стереохімічна специфічність полягає в тому, що фермент діє лише на один з просторових стереоізомерів. Наприклад, α-глюкозидаза розщеплює тільки метил-α-D-глюкозид і не діє на його стереоізомер — метил-β-глюкозид. Стереохімічна специфічність властива не тільки ферментам, які каталізують розпад речовин, а й їх синтез.
Оборотність дії ферментів. Дослідження дії ферментів показало, що вони залежно від умов можуть каталізувати як пряму, так і оборотну реакції. Наприклад, фермент гліколізу глюкозофосфатізомераза каталізує перетворення глюкозо-6-фосфату в фруктозо-6-фосфат. За певних умов вона може каталізувати процес перетворення фруктозо-6-фосфату в глюкозо-б-фосфат. Вперше оборотність дії ферментів виявив ще в 1888 р. російський учений О. Я. Данилевський, вивчаючи розщеплення білків ферментами шлункового соку.
Необхідно зазначити, що оборотність дії властива не всім ферментам. Цілий ряд реакцій синтезу і розпаду однієї й тієї самої сполуки каталізується різними ферментами.
Дія на ферменти активаторів та інгібіторів. На активність ферментів часто впливає наявність у розчинах ряду хімічних сполук. Одні з них підвищують активність ферментів, інші знижують. Перші називаються активаторами, а другі — інгібіторами (паралізаторами).
До речовин, які діють на ферменти як активатори, належать катіони металів і деякі аніони. Особливо часто як активатори ферментів використовують катіони магнію, калію, кальцію, марганцю, натрію, цинку, кобальту, аніони хлору. Наприклад, фермент аденозинтрифосфатаза м’язів, що каталізує розщеплення АТФ на АДФ і ортофосфорну кислоту, активується іонами кальцію, а аденозинтрифосфатаза в мембранах клітин активується катіонами натрію і калію. Амілаза слини та амілаза підшлункової залози активується аніонами хлору. У ряді випадків катіони металів — заліза, магнію, цинку і деяких інших входять до складу про- стетичної групи ферментів і полегшують утворення фермент-субстратного комплексу. В інших випадках іони металів сприяють приєднанню небілкової частини до апофермента або забезпечують утворення четвертинної структури ферментів.
Функцію активаторів ферментів можуть виконувати також і органічні речовини. Так, дія ліпази активується жовчними кислотами, а тканинні протеази підвищують свою активність внаслідок дії на них сполук, що містять сульфгідрильні групи — цистеїну, глутатіону тощо.
Інгібітори спричинюють гальмування ферментативних процесів. Механізм дії інгібіторів досить різний, та здебільшого він зводиться до двох типів гальмування: конкурентного і неконкурентного.
При конкурентному гальмуванні інгібітор має структуру, подібну до субстрату, тому між ними і виникає конкуренція за взаємодію з ферментом. Оскільки інігібітор є структурним аналогом субстрату, то він зв’язується з активним центром ферменту і кількість утворюваного фермент-субстратного комплексу зменшується, а тому знижується і ферментативна активність. Однак це гальмування є оборотним, бо після видалення інгібітора відновлюється здатність ферменту взаємодіяти із субстратом. Між субстратом і інгібітором існує певне кількісне співвідношення. Якщо концентрація інгібітора більша за концентрацію субстрату (I>S), то інгібітор, зв’язуючись з ферментом, виключає його з відповідної реакції і субстрат не розщеплюється. Якщо відбувається зворотне явище, тобто концентрація субстрату більша, ніж інгібітора (S>I), то з ферментом зв’язуватиметься субстрат, який далі розпадатиметься з утворенням продуктів реакції. Отже, дія конкурентних інгібіторів може послаблюватись або повністю зникати з підвищенням концентрації субстрату в навколишньому середовищі.
Прикладом такого інгібітора може бути малонова кислота (НООС—СН2—СООН). Вона є конкурентним інгібітором сукцинатдегідрогенази, а її субстратом — янтарна кислота (НООС—СН2—СН2—СООН).
При неконкурентному гальмуванні інгібітор взаємодіє з важливими функціональними групами ферменту, які розміщені в більшості випадків на ділянці алостеричного центру ферменту. Це призводить до зміни структури активного центру і субстрат не може з ним з’єднуватися, тобто фермент інактивується. Такий тип гальмування каталітичної активності ферментів називається ще алостеричним.
Алостерична регуляція активності ферментів. Суть даного виду регуляції дії ферментів полягає в тому, що ті або інші речовини діють на алостеричний центр, а останній, залежно від природи цих речовин, може зумовлювати відповідні структурні зміни в активному центрі. В одних випадках ці зміни спричиняють руйнування активного центру ферменту, а отже, і його- інактивацію. В інших — можуть виникати такі структурні зміни в активному центрі, які активують функцію ферментів (мал. 19).
Регулюючу дію на ферменти через алостеричні центри можуть виявляти гормони, продукти обміну речовин, медіатори нервової системи та інші речовини. їх називають алостеричними ефекторами. Наприклад, збільшення концентрації молочної кислоти, яка є кінцевим продуктом гліколізу, призводить до зниження активності гексокінази, тобто ферменту, що каталізує процес фосфорилювання глюкози. Це в свою чергу гальмує всі основні етапи гліколізу, які ведуть до утворення молочної кислоти. Коли концентрація молочної кислоти знижується до норми, активність гексокінази відновлюється. У цьому випадку регулюючий вплив молочної кислоти відбувається за принципом зворотного зв’язку.
Відомо, що речовини, які утворюються в клітинах, є продуктами кількох послідовних реакцій. Щоб припинити процес утворення певної речовини, достатньо виключити якусь одну ланку цього процесу. Це свідчить про те, що в багатоступеневих процесах є один або незначна кількість ферментів, які мають алостеричні властивості. Такі ферменти ще називають регуляторними. До них належать ферменти, які каталізують початкові реакції великих біохімічних циклів або вузлові реакції, тобто такі, які відбуваються на межі кількох циклів. Як бачимо, регуляторних ферментів існує значно менше, ніж звичайних. Дослідження показали, що регуляторні ферменти — це здебільшого складні четвертинні структури, які складаються з кількох субодиниць. В одній з них міститься каталітичний центр, в іншій — алостеричний.
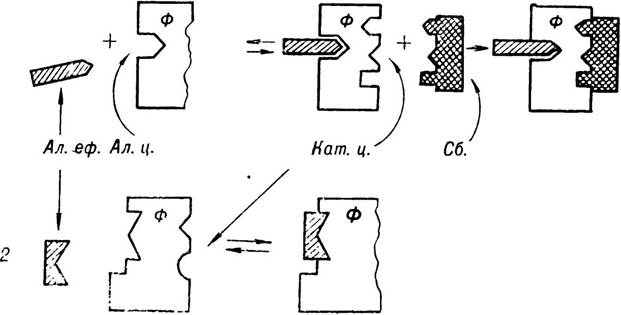
Мал. 19. Алостерична регуляція активності ферментів.
(зa О. Д. Брауном і М. Д. Фадєєвою).
Алостеричний ефектор (Ал. еф.) приєднується до алостеричного центру (Ал. ц.) ферменту (ф), що призводить до зміни конформації молекули ферменту. 1 — в результаті приєднання Ал. еф. в молекулі ферменту утворився каталітичний центр (Кат. ц.), і фермент набуває здатності до специфічної взаємодії із субстратом (Сб.), тобто набуває активності. 2 — в результаті приєднання Ал. еф. до молекули ферменту в нього виникає каталітичний центр, фермент втрачає активність.
Використання ферментів
Чим більше збагачуються наші знання про ферменти, тим ширше використовуються вони в різних галузях народного господарства. Важливим є те, що ферментологічні виробництва не потребують складного устаткування і значних матеріальних витрат на апаратуру. Водночас цінним є відсутність у ферментів токсичних властивостей, шкідливих для організму людини і тварин.
Ферменти широко використовуються в харчовій промисловості. Наприклад, дріжджі з участю своїх ферментів можуть перетворювати (зброджувати) вуглеводи в етиловий спирт. Цю здатність мікроорганізмів використовують у промисловому виробництві етилового спирту.
Ферменти дріжджів каталізують процеси розщеплення крохмалю до декстринів. Тому вони широко використовуються для випікання хлібобулочних виробів.
Молочнокислі мікроорганізми перетворюють цукри в молочну кислоту. Цей вид бродіння широко застосовується в молочній промисловості для виробництва різноманітних молочних продуктів — кефіру, простокваші тощо, а також при силосуванні кормів. З участю ферментів молочнокислих бактерій відбувається перетворення легкозброджуваних цукрів зеленого корму у молочну кислоту. З утворенням молочної кислоти масовою часткою 2 % припиняється діяльність всіх організмів. Корм за таких умов стає законсервованим.
Останнім часом широко використовуються очищені ферменти, виділені з різних біологічних джерел. Так, фермент хімозин, виділений із слизової оболонки сичуга, зумовлює зсідання білків молока і широко використовується в сироварінні.
З грибів та інших мікроорганізмів виділяють протеолітичні ферменти, які розщеплюють білки. Ці ферменти використовують у харчовій промисловості для пом’якшення м’яса і риби та обробки пива, щоб запобігти його помутнінню.
Не так давно розроблено промисловий спосіб добування ферменту глюкозооксидази, яка має антибактеріальні властивості. Вона може при наявності кисню окислювати глюкозу з утворенням б-лактону глюконової кислоти і пероксиду водню, які також характеризуються бактеріостатичною і бактерицидною дією.
Оскільки окислення глюкози глюкозооксидазою супроводжується споживанням кисню, то фермент використовується там, де треба позбутися кисню, щоб запобігти окисленню відповідних речовин. Це застосовують у харчовій промисловості для продовження строку зберігання різних продуктів, що швидко псуються.
Ряд виділених ферментів та їх препаратів використовується в тваринництві. Так, завдяки використанню 3 г пепсину на добу для підгодовування поросяти віком 2—4 місяці середньодобовий приріст його підвищується на 18 % і знижується використання кормів на одиницю приросту на 15 %. Для підгодовування телят, поросят, ягнят використовуються різні ферменти і препарати (аваморин, орізин, тирозин), які мають протеолітичну та амілолітичну дію. Вони сприяють підвищенню продуктивності тварин на 8— 15 %. Вважають, що ферменти доцільно згодовувати лише молодим тваринам, в яких ферментні системи, що здійснюють травлення в шлунку, ще недостатньо розвинені.
У клінічній практиці ферментні препарати використовують у вигляді допоміжних (неспецифічних) засобів при лікуванні різних захворювань, головним чином для видалення нежиттєвоздатних тканин, лізису тромбів різних ексудатів, а також при патологічних станах організму, які зумовлюють зменшення вмісту відповідних ферментів.
Нині в терапії при різних захворюваннях використовується вже кілька десятків ферментних препаратів. Серед них найчастіше застосовуються ферменти лізуючого типу — фібринолізин, стрептодин, трипсин, хімотрипсин та ін. Цінною властивістю цих ферментів є те, що вони розщеплюють переважно нежиттєздатні денатуровані білки і практично не діють на живі тканини.
Уже нагромаджено значний клінічний досвід щодо успішного використання ферментів-протеїназ у хірургічній практиці при обробці ран, довго незаживаючих виразок, лікуванні хронічних остеомієлітів та інших захворювань, які важко піддаються звичайному лікуванню.
Протеолітичні ферменти використовують для розщеплення тромбів у хворих тромбозами судин, зокрема при тромбофлебітах. При тромбозах відбувається депресія механізмів, які запобігають зсіданню крові, що зумовлює гальмування фібринолітичної активності крові. Щоб підвищити фібриноліз, вводять в кров протеолітичний фермент крові фібринолізин (плазмін), або активатори, які перетворюють неактивну форму — профібринолізин в активний фібринолізин. Такі властивості мають ферменти стрептокіназа і урокіназа.
Ферменти використовують і в діагностиці різних захворювань. Підвищення або зниження активності ферментів в крові порівняно з нормою є об’єктивним показником патологічних змін в організмі. Ферментативна діагностика високо специфічна і дає можливість визначити відхилення на ранніх етапах захворювання.
Водночас необхідно зазначити, що першопричиною ряду захворювань є порушення синтезу і нормальної активності ферментів, тобто так звані ферментопатії. До них належить чимало спадкових захворювань, зокрема галактоземія, різні види гемолітичної анемії, глікогенази, різні форми порушення зсідання крові та ін.
Ферментопатії можуть бути токсичного або аліментарного походження. У першому випадку активність ферментів порушується внаслідок дії на них відповідних отрут або токсинів. Аліментарна ферментопатія може виникнути при недостатньому забезпеченні організму речовинами, що необхідні для синтезу і діяльності ферментів. До таких речовин відносять білки, вітаміни, мінеральні речовини тощо.
Отже, ферменти — основні речовини в обмінних процесах організму. Крім того, вони використовуються в харчовій промисловості, сільському господарстві та медицині.