БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.1. Загальна характеристика ферментів як біологічних каталізаторів
7.1.1.Специфічність
Біологічна функція ферменту, як і будь-якого білка, зумовлена наявністю в його структурі активного центру. Ліганд, котрий взаємодіє з цим центром, називають субстратом. В активному центрі ферменту є амінокислотні залишки, функціональні групи яких забезпечують зв'язування субстрату, і амінокислотні залишки, функціональні групи яких здійснюють хімічне перетворення субстрату. Умовно їх позначають як ділянку зв'язування субстрату й каталітичну ділянку, проте необхідно пам'ятати, що не завжди ці ділянки мають чітке просторове розмежування, іноді вони можуть "перекриватися" (рис. 7.1).
У ділянці зв'язування субстрат за допомогою нековалентних зв'язків взаємодіє (зв'язується) з ферментом, формуючи ферментосубстратний комплекс, а в каталітичній він піддається хімічному перетворенню на продукт, який потім вивільнюється з активного центру ферменту. Схематично процес каталізу можна зобразити таким рівнянням:
![]()
де Е - фермент (ензим), S - субстрат, Р - продукт. Наведені позначення є загальноприйнятими й походять від англійських слів enzyme, substrat, product.

Рис. 7.1. Будова активного центру ферменту:
А - приєднання субстрату до ферменту в активному центрі; Б - положення амінокислотних залишків, які формують активний центр ферменту, у первинній структурі білка; В - активний центр (АЦ) ферменту умовно поділяється на ділянку зв'язування (ДЗ) і каталітичну ділянку (КД). ДЗ представлена радикалами амінокислот, функціональні групи яких забезпечують зв'язування субстрату. КД утворена радикалами амінокислотних залишків, функціональні групи яких забезпечують хімічне перетворення субстрату
Специфічність - найважливіша властивість ферментів, яка визначає біологічну важливість цих молекул. Розрізняють субстратну й каталітичну специфічності ферменту, що визначаються будовою активного центру (рис. 7.2). Під субстратною специфічністю розуміють здатність кожного ферменту взаємодіяти з одним або декількома певними субстратами.
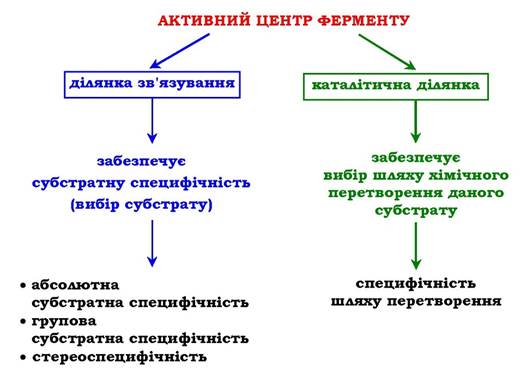
Рис. 7.2. Функціональна значимість окремих ділянок активного центру ферменту
Розрізняють:
✵ абсолютну субстратну специфічність;
✵ групову субстратну специфічність;
✵ стереоспецифічність.
Активний центр ферментів, якому притаманна абсолютна субстратна специфічність, є комплементарним лише до одного субстрату. Потрібно зазначити, що таких ферментів у живих організмах мало. Прикладом ферменту з абсолютною субстратною специфічністю є аргіназа, яка каталізує розщеплення аргініну до сечовини й орнітину:

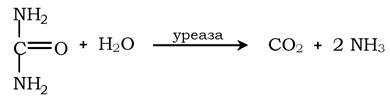
Інший приклад ферменту з абсолютною субстратною специфічністю - уреаза, вона каталізує гідроліз сечовини до діоксиду вуглецю й аміаку:
Більшість ферментів каталізує однотипні реакції з невеликою кількістю (групою) структурно схожих субстратів. Так, фермент панкреатична ліпаза каталізує гідроліз жирів у дванадцятипалій кишці людини, каталізуючи перетворення будь-якої молекули жиру (триацилгліцеролу) до молекули моноацилгліцеролу та двох молекул вищих жирних кислот. Панкреатична ліпаза гідролізує ефірний зв'язок біля α-атомів вуглецю гліцеролу, незалежно від того, які жирні кислоти входять до складу молекули жиру:

Більшість протеолітичних ферментів, що здійснюють гідроліз білків, має групову субстратну специфічність. Ензими гідролізують пептидні зв'язки, утворені певними амінокислотами.
Стереоспецифічність. За наявності в субстраті декількох стереоізомерів фермент виявляє абсолютну специфічність до одного з них. В організмі людини спостерігають специфічність ферментів до таких стереоізомерів, як D-цукри, L-амінокислоти, цистранс-ізомери, а- і β-глікозидні зв'язки.
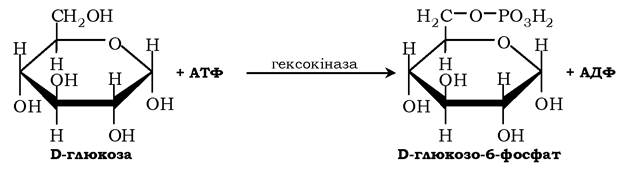
Більшість моноцукрів і продуктів їхнього обміну в організмі людини та інших ссавців належать до D-стереоізомерів. Ферменти, котрі здійснюють їхній метаболізм, мають специфічність до D-, а не до L-цукрів:
Білки людини складаються з амінокислот L-ряду. Більшість ферментів, які забезпечують перетворення амінокислот, має стерео-специфічність до L-амінокислот.
Фермент фумараза діє тільки на фумарат. Малеїнат (цис-ізомер фумарату) не є субстратом фумарази:
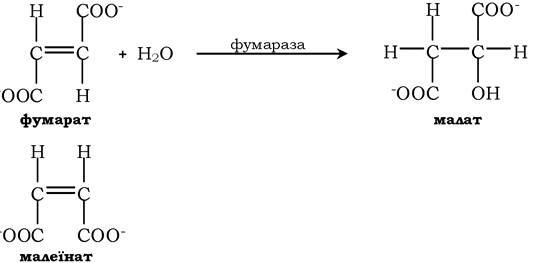
Винятком є тільки ферменти епімерази (рацемази), котрі каталізують перетворення оптичних ізомерів.
Фермент амілаза діє тільки на α-глікозидні зв'язки, що дозволяє гідролізувати крохмаль і глікоген (полімери глюкози), залишки яких сполучені α-глікозидними зв'язками. Целюлоза - теж полімер глюкози, однак залишки глюкози в ній сполучені β-глікозидними зв'язками. Через відсутність у людини ферментів, які специфічно розщеплюють β-глікозидний зв'язок, целюлоза не гідролізується в кишечнику людини й не може служити джерелом глюкози.
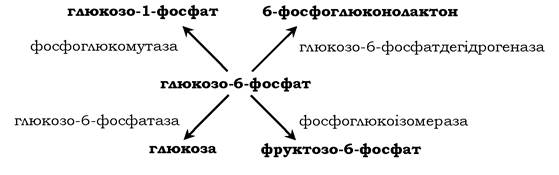
Фермент каталізує перетворення приєднаного субстрату одним із можливих шляхів його перетворення. Ця властивість забезпечується будовою каталітичної ділянки активного центру ферменту й називається каталітичною специфічністю, або специфічністю шляху перетворення субстрату. Так, молекула глюкозо-6-фосфату в клітинах печінки людини - субстрат чотирьох різних ферментів: фосфоглюкомутази, глюкозо-6-фосфат- фосфатази, фосфоглюкозоізомерази та глюкозо-6-фосфатде- гідрогенази. Але через особливості будови каталітичних ділянок цих ферментів відбувається різне перетворення цієї сполуки з утворенням чотирьох різних продуктів: