БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.4.Механізм дії ферментів
7.4.3.Молекулярні механізми ферментативного каталізу
Механізми ферментативного каталізу визначаються роллю функціональних груп активного центру ферменту в хімічній реакції перетворення субстрату на продукт. Виділяють два основні механізми ферментативного каталізу: кислотно-основний і ковалентний.
Концепція кислотно-основного каталізу пояснює ферментативну активність участю в хімічній реакції кислотних груп (донорів протонів) і/або основних груп (акцепторів протонів). Кислотно- основний каталіз - явище, яке часто зустрічається. Амінокислотні залишки, що входять до складу активного центру, мають функціональні групи, які виявляють властивості як кислот, так і основ.
До амінокислот, що беруть участь у кислотно-основному каталізі, насамперед належать Цис, Тир, Сер, Ліз, Глу, Асп і Гіс. Їхні радикали у протонованій формі - кислоти (донори протону), у депротонованій - основи (акцептори протонів). Завдяки цій властивості функціональних груп активного центру ферменти стають унікальними біологічними каталізаторами, на відміну від небіологічних каталізаторів, здатних виявляти або кислотні, або основні властивості. Як приклад кислотно-основного каталізу, в якому кофакторами є Zn2+, а як кофермент використовується молекула НАД+, наведемо фермент алкогольдегідрогеназу печінки, що каталізує реакцію окиснення спирту (див. рис. 7.13):
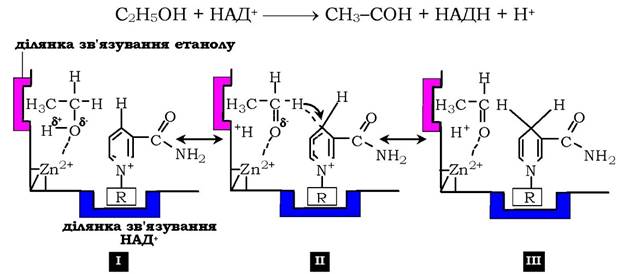
Рис. 7.13. Механізм кислотно-основного каталізу на прикладі алкогольдегідрогенази печінки:
I - молекула етилового спирту має центр зв'язування, що забезпечує гідрофобну взаємодію активного центру та метильної групи спирту;II - позитивно заряджений атом цинку сприяє відщепленню протона
від спиртової групи етанолу з утворенням негативно зарядженого атома кисню. Від'ємний заряд перерозподіляється між атомом кисню й сусіднім атомом водню, який потім у вигляді гідрид-іону переноситься на четвертий вуглецевий атом нікотинаміду коферменту НАД+; ІІІ - у результаті формується відновлена форма НАДН та оцтовий альдегід
Ковалентний каталіз заснований на атаці нуклеофільних (негативно заряджених) або електрофільних (позитивно заряджених) груп активного центру ферменту молекулами субстрату з формуванням ковалентного зв'язку між субстратом і коферментом або функціональною групою амінокислотного залишку (як правило, однією) активного центру ферменту.
Дія серинових протеаз, таких як трипсин, хімотрипсин і тромбін, - приклад механізму ковалентного каталізу, коли ковалентний зв'язок утворюється між субстратом і амінокислотним залишком серину активного центру ферменту. Термін "серинові протеази» пов'язаний з тим, що амінокислотний залишок серину входить до складу активного центру всіх цих ферментів і бере участь безпосередньо в каталізі. Розглянемо механізм ковалентного каталізу на прикладі хімотрипсину, який здійснює гідроліз пептидних зв'язків під час перетравлювання білків у дванадцятипалій кишці. Субстратами хімотрипсину слугують пептиди, які містять амінокислоти з ароматичними і циклічними гідрофобними радикалами (Фен, Тир, Три), що вказує на участь гідрофобних сил у формуванні ферментосубстратного комплексу. Механізм ковалентного каталізу хімотрипсину зображено на рис. 7.14.

Рис. 7.14. Механізм ковалентного каталізу в активному центрі хімотрипсину
Радикали Асп102, ГІС57 і Сер195 беруть участь безпосередньо в акті каталізу. Унаслідок нуклеофільної атаки пептидного зв'язку субстрату відбувається розрив цього зв'язку з утворенням ковалентно-модифікованого серину - ацилхімотрипсину. Інший пептидний фрагмент вивільнюється внаслідок розриву водневого зв'язку між пептидним фрагментом і Гіс57 активного центру хімотрипсину. Завершальний етап гідролізу пептидного зв'язку білків - деацилювання хімотрипсину в присутності молекули води з вивільненням другого фрагменту гідролізованого білка і вихідної форми ферменту.