БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.6.Інгібування ферментативної активності
7.6.1.Оборотне інгібування
Оборотні інгібітори зв'язуються з ферментами слабкими неко- валентними зв'язками і за певних умов легко відокремлюються від ферменту. Є два види оборотного інгібування - конкурентне й неконкурентне.
Конкурентне інгібування. Для нього характерне оборотне зниження швидкості ферментативної реакції, викликане інгібітором, що зв'язався з активним центром ферменту й перешкоджає утворенню ферментосубстратного комплексу. Такий тип інгібування спостерігають, коли інгібітор є структурним аналогом субстрату. У результаті даного типу інгібування виникає конкуренція молекул субстрату й інгібітору за місце зв'язування в активному центрі ферменту. У такому випадку з ферментом взаємодіє або субстрат, або інгібітор, утворюючи комплекси фермент - субстрат (ES) або фермент - інгібітор (ЕІ). Унаслідок формування комплексу ферменту та інгібітору продукт реакції не утворюється (рис. 7.21). Для конкурентного типу інгібування справедливі такі рівняння:
![]()
Класичний приклад конкурентного інгібування - інгібування сук- цинатдегідрогеназної реакції малоновою кислотою (рис. 7.22).
Остання є структурним аналогом сукцинату (наявність двох карбоксильних груп) і може також взаємодіяти з активним центром сукцинатдегідрогенази. Але відщеплення двох атомів водню від малонової кислоти неможливе, отже, швидкість реакції знижується.
Конкурентні інгібітори зменшують швидкість хімічної реакції. Конкурентний інгібітор підвищує Km для даного субстрату (зменшує спорідненість субстрату до ферменту). Це означає, що в присутності конкурентного інгібітору необхідна велика концентрація субстрату для досягнення 1/2 Vmax.
Збільшення співвідношення концентрації субстрату та інгібітору знижує ефективність інгібування. При значно вищих концентраціях субстрату інгібування повністю зникає, оскільки активні центри всіх молекул ферменту знаходитимуться переважно в комплексі із субстратом.
Багато лікарських препаратів чинять свій терапевтичний вплив за механізмом конкурентного інгібування. Так, четвертинні амонієві основи інгібують ацетилхолінестеразу, яка каталізує реакцію гідролізу ацетилхоліну на холін і оцтову кислоту: 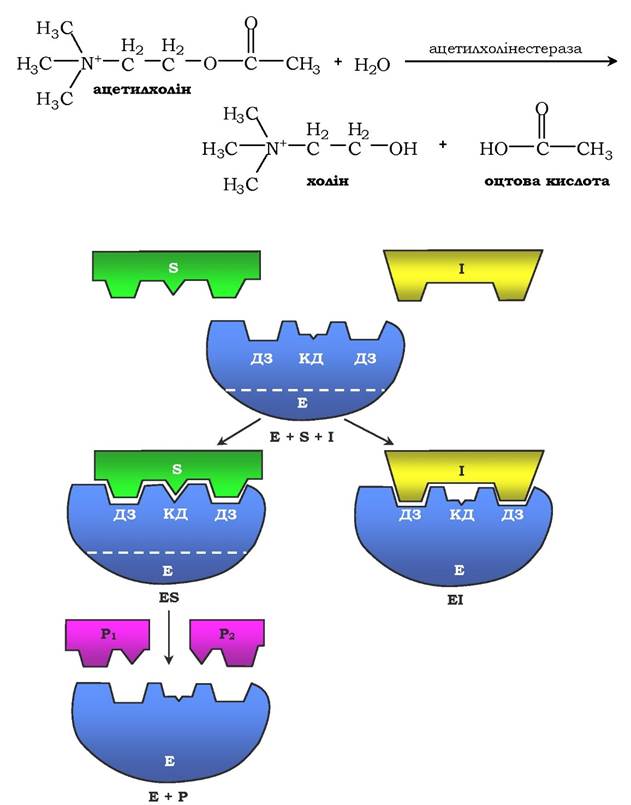
Рис. 7.21. Схема конкурентного інгібування активності ферменту:
ДЗ - ділянка зв'язування; КД - каталітична ділянка
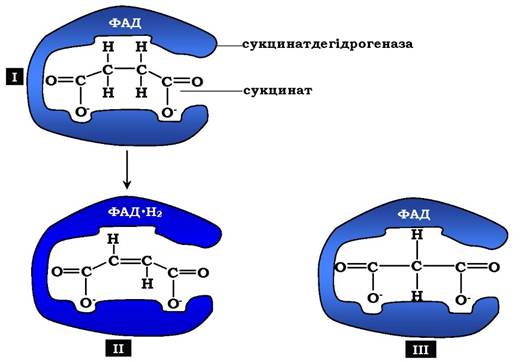
Рис. 7.22. Приклад конкурентного інгібування сукцинатдегідрогенази малоновою кислотою: І - сукцинат зв'язується з активним центром ферменту сукцинатдегідрогенази; ІІ - під час ферментативної реакції відбувається відщеплення двох атомів водню від сукцинату й приєднання їх до коферменту ФАД. У результаті утворюється фурамат, який звільняється з активного центру сукцинатдегідрогенази;
ІІІ - малонова кислота - структурний аналог сукцинату, вона також зв'язується з активним центром сукцинатдегідрогенази.
При цьому хімічна реакція не відбувається
Унаслідок додавання інгібіторів активність ацетилхолінестерази зменшується, концентрація ацетилхоліну (субстрату) збільшується, що супроводжується посиленням проведення нервового імпульсу. Інгібітори холінестерази використовують у лікуванні м'язової дистрофії. Ефективні антихолінестеразні препарати - прозерин, ендрофоній тощо (рис. 7.23).
Як інгібітори ферментів за конкурентним механізмом у медичній практиці використовують речовини, які називаються антиметаболітами. Ці сполуки, будучи структурними аналогами природних субстратів, викликають, з одного боку, конкурентне інгібування ферментів і, з іншого, можуть використовуватися цими самими ферментами як псевдосубстрати, що приводить до синтезу аномальних продуктів, які не є функціонально активними. У результаті спостерігається зниження швидкості певних метаболічних шляхів.
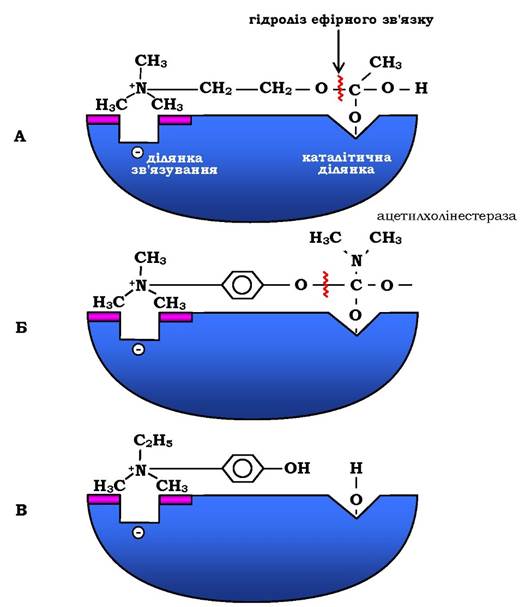
Рис. 7.23. Схема активного центру ацетилхолінестерази:
А - приєднання ацетилхоліну в активному центрі ферменту. Стрілкою вказано місце гідролізу ефірного зв'язку в молекулі ацетилхоліну; Б - приєднання конкурентного інгібітору - прозерину в активному центрі ферменту. Указано місце гідролізу прозерину, але реакція проходить набагато повільніше, ніж з ацетилхоліном; В - приєднання конкурентного інгібітору ендорфонію до активного центру ферменту. Ендорфоній зв'язується в активному центрі ацетилхолінестерази, перешкоджаючи приєднанню ацетилхоліну
Як лікарські препарати використовують такі антиметаболіти: сульфаніламідні препарати (аналоги параамінобензойної кислоти), що застосовуються для лікування інфекційних хвороб, аналоги нуклеотидів для лікування онкологічних захворювань.
Неконкурентне інгібування. Цим терміном називають таке інгібування ферментативної реакції, за якого інгібітор взаємодіє з ферментом у ділянці, відмінній від активного центру (рис. 7.24). Неконкурентні інгібітори не є структурними аналогами субстратів.
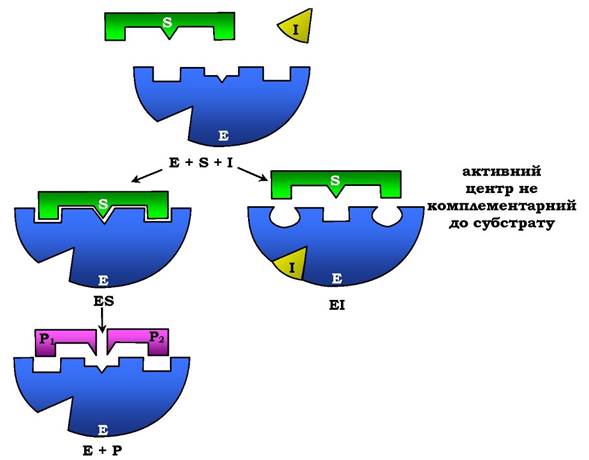
Рис. 7.24. Схема неконкурентного інгібування активності ферменту
Неконкурентний інгібітор може зв'язуватися або з ферментом, або з ферментосубстратним комплексом, утворюючи неактивний комплекс. Приєднання неконкурентного інгібітору викликає зміну конформації молекули таким чином, що порушується взаємодія субстрату з активним центром ферменту. Це призводить до зниження швидкості ферментативної реакції.
Кінетичну залежність неконкурентного інгібування зображено на рис. 7.25. Цей тип інгібування характеризується зниженням Vmax ферментативної реакції та зменшенням спорідненості субстрату до ферменту, тобто збільшенням Km.
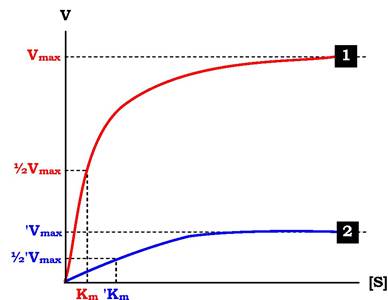
Рис. 7.25. Вплив неконкурентного інгібітору на швидкість ферментативної реакції залежно від концентрації субстрату: 1 - за відсутності змішаного неконкурентного інгібітору; 2 - у присутності змішаного неконкурентного інгібітору; Vmax - максимальна швидкість реакції за відсутності інгібітору; 'Vmax- максимальна швидкість реакції в присутності інгібітору; Km - константа Міхаеліса за відсутності інгібітору; ' Km - константа Міхаеліса в присутності інгібітору