БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 13. СТРУКТУРА І ВЛАСТИВОСТІ ЛІПІДІВ
13.1. Структурні компоненти ліпідів
Загальними структурними компонентами молекул ліпідів є вищі жирні кислоти або вищі аліфатичні спирти та альдегіди.
Вищі жирні кислоти (ВЖК) входять до складу молекул ліпідів у вигляді простих і складних ефірів або амідів. Зустрічаються також вільні неетерифіковані жирні кислоти, які становлять приблизно 3 % фракції нейтральних ліпідів. Відомо понад 200 природних жирних кислот, молекули яких складаються з гідрофільної карбоксильної групи та гідрофобних вуглеводних ланцюгів, котрі різняться кількістю атомів вуглецю, наявністю гідрокси- та оксогруп, ступенем ненасиченості. Природні жирні кислоти, як правило, мають парну кількість атомів вуглецю (найчастіше 16 і 18 атомів). Аліфатичні ланцюги жирних кислот можуть бути повністю насиченими або мати один чи декілька подвійних, іноді потрійних зв'язків.
Насичені жирні кислоти є головними компонентами жирів, масел, восків тощо. Найчастіше це аліфатичні карбонові кислоти, котрі містять від 12 до 24 атомів вуглецю, однак у природі зустрічаються також жирні кислоти з розгалуженим ланцюгом.
Коротколанцюгові жирні кислоти (масляна, капронова, капринова тощо) присутні, головним чином у молочному жирі й вершковому маслі, вищі насичені жирні кислоти (пальмітинова, стеаринова, арахінова) - у складі ліпідів жирової тканини тварин.
Ненасичені вищі жирні кислоти зустрічаються у складі ліпідів тканин тварин і рослин удвічі частіше, ніж насичені. Залежно від кількості подвійних зв'язків у молекулах ненасичені жирні кислоти поділяють на моно-, ди-, триєнові (полієнові). Подвійні зв'язки можуть бути:
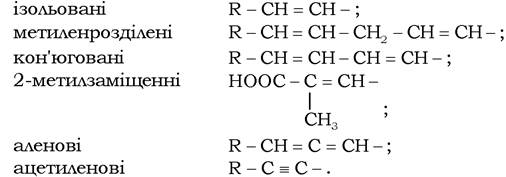
Найпоширеніші в ліпідах цис-ізомери ненасичених ВЖК, які містять ізольований або метиленрозділений подвійний зв'язок. Наявність подвійних зв'язків, незалежно від його типу, є причиною існування просторової ізомерії. Ненасичені вищі жирні кислоти значно відрізняються за просторовою конфігурацією від насичених. У насичених ВЖК алкільні радикали внаслідок можливості вільного обертання атомів навколо одинарних зв'язків мають значну гнучкість і тому здатні існувати у вигляді різноманітних конформацій. Вуглеводневі ланцюги ненасичених ВЖК через неможливість обертання атомів навколо подвійного зв'язку
мають жорсткий вигин. У цис-ізомерів природних ненасичених жирних кислот кут вигину ацильного ланцюга становить приблизно 30°, тоді як їхні транс-ізомери майже не відрізняються від конфігурації насичених вуглеводневих ланцюгів (рис. 13.1). Варто зазначити, що цис-ізомери ненасичених ВЖК менш стійкі, ніж відповідні транс-ізомери, що має важливе значення для функціонування біомембран.
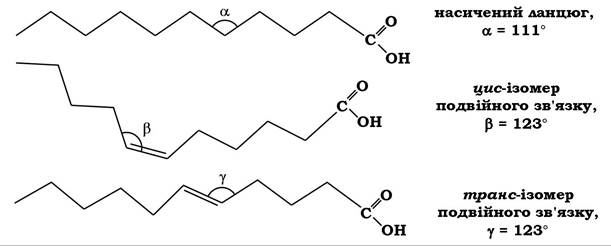
Рис. 13.1. Геометричне зображення ацильних ланцюгів і валентних кутів у молекулах вищих жирних кислот
Номенклатура жирних кислот. Природні жирні кислоти мають тривіальні й систематичні назви (табл. 13.1). Систематичні назви жирних кислот походять від назви відповідного вуглеводню з додаванням закінчення -ова. Наприклад, ВЖК-С16 називається гексадекановою відповідно до вуглеводня-С16 - гексадекану. Ненасичена жирна кислота-С16 з одним подвійним зв'язком має назву гексадекенової. Ненасичена С18-жирна кислота з двома подвійними зв'язками називається октадекадієновою, із трьома зв'язками - октадекатрієновою.
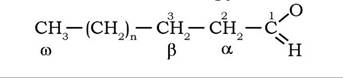
Місце подвійного зв'язку на алкільному ланцюгу жирної кислоти позначається символом Δ (дельта, грец.) з цифрою. Наприклад, символ цис-Δ9 означає наявність подвійного зв'язку в цис- конфігурації між 9-м і 10-м атомами вуглецю. Нумерація атомів вуглецю в молекулі жирної кислоти починається від карбоксильного кінця; 2-й і 3-й атоми вуглецю позначають відповідно як α- і β-, а вуглець кінцевої метильної групи - як ω-С:
Таблиця 13.1
Деякі природні жирні кислоти тварин
Кількість атомів вуглецю |
Положення подвійного зв'язку |
Назва |
Формули |
|
Тривіальна |
Систематична |
|||
Насичені жирні кислоти |
||||
4 |
- |
Масляна |
н-Бутанова |
СН3(СН2)2СООН |
6 |
- |
Капронова |
н-Гексанова |
СН3(СН2)4СООН |
8 |
- |
Капринова |
н-Октанова |
СН3(СН2)6СООН |
10 |
- |
Каприлова |
н-Деканова |
СН3(СН2)8СООН |
12 |
- |
Лауринова |
н-Додеканова |
СН3(СН2)10СООН |
14 |
- |
Міристинова |
н-Т етрадеканова |
СН3(СН2)12СООН |
16 |
- |
Пальмітинова |
н-Гексадеканова |
СН3(СН2)14СООН |
18 |
- |
Стеаринова |
н- Октадеканова |
СН3(СН2)16СООН |
20 |
- |
Арахінова |
н- Ейкозанова |
СН3(СН2)18СООН |
22 |
- |
Бегенова |
н-Доказанова |
СН3(СН2)20СООН |
24 |
- |
Лігноцеринова |
н-Тетракозанова |
СН3(СН2)22СООН |
Вищі ненасичені жирні кислоти |
||||
16 |
Δ9 |
Пальмітолеїнова |
Цис-Δ9- гексадекенова |
СН3(СН2)5СН = =СН(СН2)7СООН |
18 |
Δ9 |
Олеїнова |
Цис Δ9-октадекенова |
СН3(СН2)7СН = =СН(СН2)7СООН |
18 |
Δ9,12 |
Лінолева |
Цис-Δ9,12- октадека дієнова |
СН3(СН2)4(СН = = СНСН2)2- (СН2)6СООН |
18 |
Δ9,12,15 |
Ліноленова |
Повністю цис-Δ9,12,15 -октадекатрієнова |
СН3(СН2)(СН = СНСН2)3- (СН2)6СООН |
20 |
Δ5,8,11,14 |
Арахідонова |
Повністю цис-Δ5,8,11,14 - ейкозатетраєнова |
СН3(СН2)4(СН = = СНСН2)4- (СН2)2СООН |
Фізико-хімічні властивості ВЖК зумовлені особливостями їхньої хімічної будови. Так, температура плавлення жирних кислот залежить від молекулярної маси, а також кількості, локалізації та конфігурації подвійних зв'язків. Як правило, температура плавлення підвищується із зростанням кількості атомів вуглецю в ланцюзі. За кімнатної температури насичені жирні кислоти з числом атомів вуглецю від 1 до 8 є рідинами, а від 10 і вище - тверді речовини. Ненасичені жирні кислоти завжди плавляться за більш низької температури, ніж їхні насичені аналоги: наприклад, стеаринова кислота (Сі8) має точку плавлення 70 °С, а для олеїнової (С18, Δ9) вона становить 14 °С.
Більшість жирних кислот, за винятком розгалужених і гідроксикислот, не мають у структурі молекул асиметричних атомів вуглецю, тому вони оптично неактивні.
Нижчі жирні кислоти з короткими ланцюгами розчинні у воді (мурашина, ацетатна, пропіонова). Зі зростанням довжини ланцюга й молекулярної маси розчинність жирних кислот у полярних розчинниках знижується, а в неполярних зростає. Наприклад, лауринова кислота (С12) та її високомолекулярні гомологи вже нерозчинні у воді, але повністю розчиняються в неполярних розчинниках (хлороформі, бензолі, ефірах тощо).
Жирні кислоти слабко дисоціюють у воді (рК ~ 5), тому їх відносять до слабких кислот.
Вищі жирні кислоти здатні утворювати на поверхні води плівку, яка є мономолекулярним шаром, в якому гідрофільні карбоксильні групи взаємодіють з водою, а гідрофобні вуглеводневі радикали орієнтовані перпендикулярно до поверхні води.
У розбавлених водних розчинах КаОН або КОН жирні кислоти можуть утворювати міцели, які перетворюються на "мила" - Na+ - і K+ -солі жирних кислот. Na+ - або K+ -мила - це амфіпатичні сполуки, що мають іонізовану карбоксильну групу - полярну "голову" і неполярний "хвіст". Це природні емульгатори жирів. Їхні гідрофобні радикали занурюються в краплини масел, а гідрофільні голови взаємодіють з водою, формуючи гідрофільну оболонку навколо крапель жиру й утворюючи таким чином емульсії, тобто дрібнодисперсну суміш частинок жиру у воді. Ca2+- і Mg2+-солі важко розчинні у воді й тому не здатні утворювати емульсію.
Для виділення вищих жирних кислот із біологічного матеріалу застосовують методи, засновані на різній їхній розчинності в полярних і неполярних розчинниках, здатності до утворення комплексів із сечовиною та тіосечовиною тощо. Розділення ВЖК здійснюють методами адсорбційної, розподільної, газорідинної хроматографії.
Вищі спирти й альдегіди. Вищі спирти містяться в складі різноманітних ліпідів у вигляді простих ефірів. Це в основному залишки високомолекулярних спиртів з парним числом атомів вуглецю, з довгими нерозгалуженими вуглецевими ланцюгами, які можуть бути як насиченими CH3-(CH2)n-CH2OH, де n = 6-30, так і ненасиченими CH3-(CH2)n-CH = CH-(CH2)m-CH2OH , а також розгалужених вищих жирних спиртів - похідних ізопрену:

та залишки полієнових первинних спиртів (терпенолів):

де n = 2-13.
З вищими жирними кислотами вищі одноатомні жирні спирти утворюють естери - воска:

де m= 12-34,n= 16-22.
В організмах рослин і тварин воска виконують функції гідрозахисту зовнішніх покривів листя, стебел, плодів, шкіри, шерсті, пір'я у тварин, а також резервну функцію енергозабезпечення у планктонних організмів.
Вищі жирні альдегіди - входять до складу плазмалогенів. Їхня частка в складі ліпідів незначна, але вуглеводневі ланцюги альдегідів досить різноманітні за структурою і ступенем насиченості. Загальною формулою для вищих насичених альдегідів є CH3(CH2)nCHO, де n = 6-20, для вищих жирних ненасичених альдегідів -
![]()
Вищі ненасичені ізопреноїдні альдегіди є складовими рослинних ароматів і феромонів комах, наприклад гераніаль:
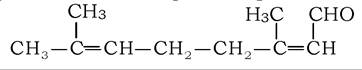
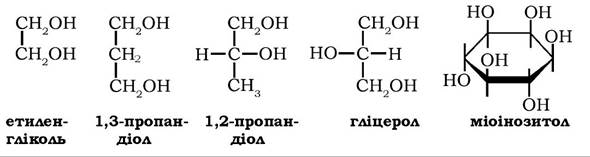
Багатоатомні спирти у природних ліпідах представлені переважно діолами (етиленгліколь, 1,2-та 1,3-пропандіол), гліцеролом, міоінозитолом і вищими аміноспиртами: