БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 15. ІНТЕГРАЦІЯ МЕТАБОЛІЧНИХ ШЛЯХІВ. ГОРМОНИ
15.9.Кортикостероїди
У корі надниркових залоз синтезується більше 40 метаболітів, які розрізняються за структурою і біологічною активністю та утворюються з холестерину.
На першому етапі синтезу кортикостероїдів за участю гідроксилази, яка належить до групи цитохромів Р450, відбуваються перетворення холестерину в прегненолон шляхом відщеплення 6-вуглецевого фрагмента від бічного ланцюга холестерину й окис- нення С20-вуглецевого атома. (рис. 15.11) Прегненолон перетворюється в прогестерон, попередник С21-стероїдів - кортизолу й альдостерону, і С19-стероїди, попередники андрогенів. Яким саме стероїдом виявиться кінцевий продукт, залежить від набору ферментів у клітині та послідовності реакцій гідроксилювання.
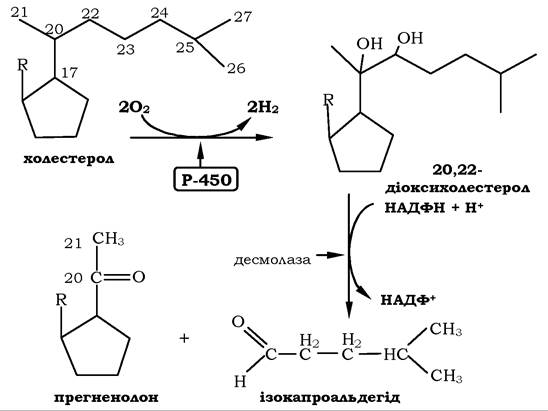
Рис. 15.11. Синтез прегненолону - попередника стероїдних гормонів
Первинне гідроксилювання прогестерону 17-гідроксилазою, а потім 21- і 11-гідроксилазою приводить до синтезу кортизолу. Реакції утворення альдостерону включають гідроксилювання прогестерону спочатку 21-гідроксилазою, а потім 11-гідроксилазою, а також окслинням С18 до альдегіду (рис. 15.12).
Стероїдні гормони транспортуються кров'ю в комплексі зі специфічними транспортними білками.
Джерелом холестерину для синтезу кортикостероїдів слугують його ефіри, котрі надходять у клітину в складі ліпопротеїнів низької щільності (ЛПНЩ) чи депоновані в клітині. Звільнення холестерину з його ефірів і синтез кортикостероїдів стимулюються кортикотропіном.
Реакція синтезу кортизолу відбувається в різних компартментах клітин кори надниркових залоз - мітохондріях та ЕР. Швидкість синтезу та секреції кортизолу регулюється гіпоталамогіпофізарною системою за механізмом негативного зворотного зв'язку й стимулюється у відповідь на стрес, травму, інфекцію.
Синтез кортизолу починається з перетворення прегненолону в прогестерон під дією ферменту 3-р-гідроксистероїддегідрогенази й проходить у цитозолі, куди прегненолон надходить із мітохондрій.
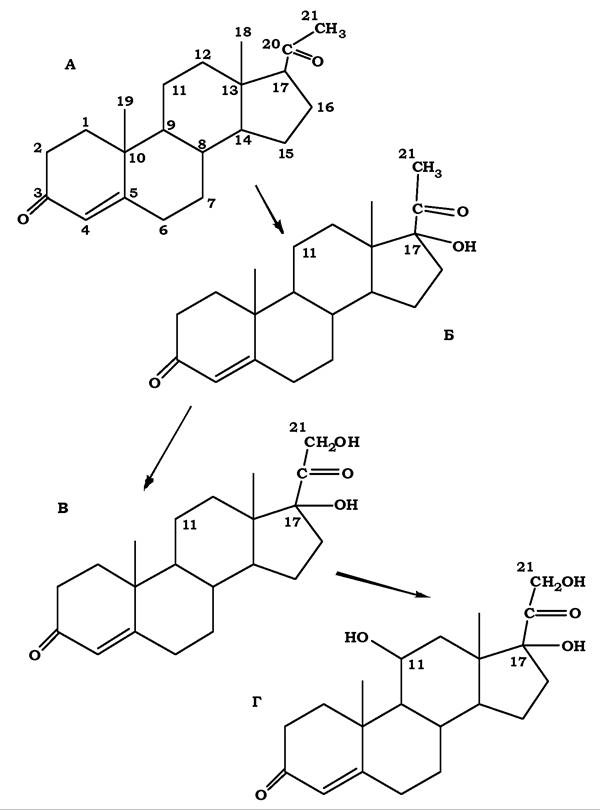
Подальші перетворення відбуваються на мембрані ЕР, де за участю 17-а-гідроксилази йде гідроксилювання прогестерону по С17, а потім, за участю 21-гідроксилази, - по С21. Утворений 11-дезоксикортизол переноситься на внутрішню мембрану мітохондрій, де гідроксилюється по С11 з утворенням кортизолу (рис. 15.13).
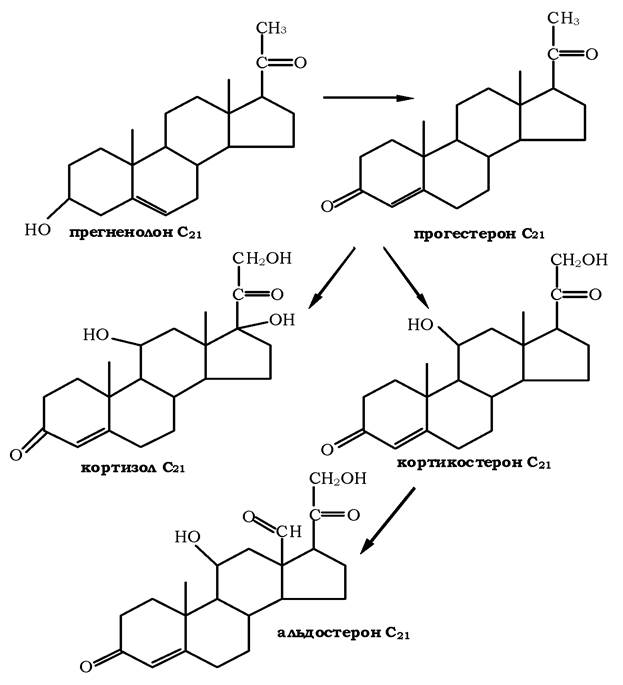
Рис. 15.13. Схема синтезу кортизолу:
А - прогестерон, Б - 17-гідроксипрогестерон, В - 11 -дезоксикортизол, Г — кортизол
У плазмі крові кортизол перебуває переважно в комплексі з α-глобуліном транскортином. Незв'язаний, або вільний, кортизол становить приблизно 8 % від загальної його кількості в плазмі і є біологічно активною фракцією.
Механізм дії глюкокортикоїдів включає їхню взаємодію зі специфічними рецепторами в цитозолі та ядрі клітини. Вплив глюкокортикоїдів на метаболізм пов'язаний з регуляцією різноманітних процесів (як катаболічних, так і анаболічних).
Кортизол стимулює утворення глюкози в печінці шляхом підсилення глюконеогенезу та збільшення швидкості вивільнення амінокислот як субстратів глюконеогннезу з периферичних тканин. У печінці кортизол індукує синтез ферментів катаболізму амінокислот і стимулює синтез глікогену. У периферичних тканинах кортизол гальмує споживання глюкози. Ефекти кортизолу у здорових людей урівноважуються інсуліном.
Обмін білків і нуклеїнових кислот регулюється глюкокортикоїдами різнонаправлено в печінці та периферичних тканинах: у печінці виявляється здебільшого анаболічний ефект, у м'язах, жировій тканині та кістках - катаболічний.
Катаболізм гормонів кори надниркових залоз відбувається насамперед у печінці. Тут проходять реакції гідроксилювання, окиснення та відновлення гормонів. Продукти катаболізму кортикостероїдів (крім кортикостерону й альдостерону) виводяться із сечею у формі 17-кетостероїдів. Ці продукти метаболізму виділяються переважно у вигляді кон'югатів із глюкуроновою та сірчаною кислотами. У чоловіків 2/3 кетостероїдів утворюються за рахунок кортикостероїдів і 1/3 - за рахунок тестостерону (усього 12-17 мг/доб.). У жінок 17-кетостероїди утворюються переважно за рахунок кортикостероїдів (7-12 мг/доб.).
Надлишкове утворення кортикостероїдів, головним чином кортизолу, - гіперкортицизм - часто є результатом порушення регуляторних механізмів синтезу кортизолу: при пухлині гіпофіза й підвищеній продукції кортикотропіну (хвороба Іценко - Кушінга); при пухлинах надниркових залоз, які виробляють кортизол (синдром Іценко - Кушінга). Основні прояви гіперкортицизму: зниження толерантності до глюкози, гіперглюкоземія та гіпертензія.
При успадкованій адреногенітальній дистрофії в 95 % випадків виявляється дефіцит 21-гідроксилази. При цьому спостерігається підвищена секреція 17-ОН-прогестерону, збільшення продукції андрогенів, раннє статеве дозрівання у хлопчиків і розвиток чоловічих статевих ознак у дівчат. У разі часткової недостатності 21-гідроксилази у жінок може порушуватися менструальний цикл.
Набута недостатність надниркових залоз може розвиватися в результаті туберкульозного чи автоімунного ушкодження. Часто це є наслідком пригнічення гіпоталамо-гіпофізарної системи регуляції за механізмом зворотного зв'язку при тривалому застосуванні кортикостероїдних препаратів. Утрата регуляторного контролю з боку надниркових залоз приводить до підвищення секреції кортикотропіну. У цих випадках у хворих відзначається посилення пігментації шкіри та слизових оболонок (хвороба Аддісона), що зумовлено підвищеною продукцією кортикотропіну й інших похідних ПОМК, зокрема меланоцитстимулюючого гормону. Основні клінічні прояви надниркової недостатності: гіпотензія, м'язова слабість, гіпонатріємія, втрата маси тіла, непереносимість стресу.
Найважливішим мінералокортикоїдом є альдостерон, який сек- ретується клубочковою зоною надниркових залоз. Головний регулятор його секреції - ренін-ангіотензинова система. Ренін, що синтезується в нирках, каталізує перетворення неактивного ангіотензи- ногену в ангіотензин І, який далі перетворюється на ангіотензин ІІ. Синтез останнього залежить від об'єму циркулюючої крові (ОЦК), і від рівня іонів натрію. Зменшення ОЦК приводить до збільшення синтезу ангіотензину ІІ, який стимулює секрецію альдостерону, що викликає затримку натрію і води та відновлення ОЦК.
Секреція альдостерону також залежить від АКТГ і рівня калію. При гіпокаліємії секреція альдостерону гальмується, а екскреція калію зменшується. І навпаки, навіть незначне підвищення рівня калію в крові викликає підсилення секреції альдостерону та екскрецію калію.