БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 4. МОЛЕКУЛЯРНА ОРГАНІЗАЦІЯ І БІОЛОГІЧНІ ФУНКЦІЇ МЕМБРАН
4.3. Функції мембран
4.3.3. Мембранні рецептори і трансдукція зовнішніх сигналів
Важливою функцією мембран є відбір із зовнішнього середовища й підсилення сигналів, які регулюють обмін речовин клітини. У більшості випадків первинні сигнали (месенджери), що інформують клітину про необхідність зміни інтенсивності обміну речовин, доставляють цю інформацію до плазматичної мембрани, але не проникають через неї. Прикладом первинних месенджерів є гормони, нейромедіатори, багато ксенобіотиків. Завдяки специфічній структурі молекул месенджери зв'язуються з мембранними рецепторами й активують їх. Активація рецепторних систем включає такі стадії:
✵ зв'язування ліганду (або агоніста) з рецептором;
✵ передача всередину плазматичної мембрани і в середину клітини інформації про зв'язування речовини з рецептором;
✵ клітинна відповідь, яка, у свою чергу, поділяється на швидку, повільну та пізню (рис. 4.16).
Відомо кілька родин рецепторних білків з гомологічними первинними структурами. Такі родини складаються із структурно родинних (але функціонально відмінних) білків (табл. 4.3).

Рис. 4.16. Схема сигнал-трансдукційних систем клітини:
R - рецептор, G - G-білок, Е - фермент, який утворює вторинний месенджер, ЕР - ендоплазматичний ретикулум,
ПК - протеїнкіназа, LR - ліганд-рецепторний комплекс. Ранні гени - відповідь у межах 15-20 хв, пізні гени - протягом годин і діб. 1-3 - сигнал-трансдукційні системи
Таблиця 4.3
Основні родини мембранних рецепторів у еукаріотів
Родина |
Приклади рецепторів |
1. Рецептори-канали й рецептори, пов'язані з переміщенням речовин через мембрану |
Нікотиновий ацетилхоліновий рецептор; рецептор γ-аміномасляної кислоти; рецептор до трансферину; рецептор ліпопротеїдів низької густини. |
2. Рецептори-ферменти (в основному з тирозинкіназною активністю) |
Рецептор фактора росту епідермісу; інсуліновий рецептор. |
3. Імуноглобулінові рецептори |
Т-клітинний рецептор; поверхневі імуноглобуліни; глікопротеїн, асоційований з мієліном; N-CAM (від англ.: молекула адгезії нервових клітин). |
4. Інтегрини (зв'язування з комплексами позаклітинного матриксу й білками адгезії) |
Фібронектинові рецептори; LFA-1 (lymphocyte function associated); MAC-1 (від макрофаг). |
5. Рецептори, які регулюють активність G-білків |
α- і β-адренергічні рецептори; родопсин; мускаринові ацетилхолінові рецептори. |
6. Інші рецептори |
Асіалоглікопротеїнові рецептори; рецептор інсуліноподібного фактора росту-2; рецептор манозо-6-фосфату. |
Сигнал, який виникає на (у) плазматичній мембрані у відповідь на активацію рецептора, приводить до утворення вторинного месенджера, що відбувається по інший бік мембрани - у цитозолі та у внутрішньому моношарі мембрани. Цей багатостадійний процес, який відбувається з підсиленням на кожній стадії, є гарантією того, що інформація первинного месенджера не буде втрачена. Ефективність такого процесу залежить не тільки від величини зовнішнього сигналу, а й від в'язкості ліпідного оточення, в якому відбувається цей процес. Уже відомо більше десяти вторинних месенджерів у різних тканинах і в різних співвідношеннях.
Отже, існує два основні механізми трансдукції зовнішнього сигналу в клітину (рис. 4.16, 3). "Гідрофобний" сигнал (стероїдні гормони, йодтиронін, вітаміни А і Д) проникає через плазматичну мембрану, потім через цитозоль у ядро і мітохондрії, де утворює комплекс із ядерними (чи мітохондріальними) рецепторами і змінює матричний синтез (чи синтез АТФ). У разі другого шляху ліганд-рецепторний комплекс утворюється на зовнішньому боці плазматичної мембрани, що викликає або швидке відкривання іонного каналу та вхід іонів Na+ у клітину (рис. 4.16, 1) і генерацію (утворення) потенціалу дії, або включення систем, які активуються вторинними посередниками, що приводить до повільніших змін метаболізму клітини (рис. 4.16, 2). Сукупність механізмів трансдукції міжклітинних сигналів у внутрішньоклітинні (у т. ч. й у внутрішньоорганоїдні) називаються сигнал-трансдукторними системами. Чотири основні й найбільш вивчені системи передачі гормональних сигналів через плазматичну мембрану зображено на рис. 4.17.
Багато гормонів (аміни, пептиди, білки, простагландини), а також запах і смак діють через утворення циклічного аденозин- монофосфату (цАМФ) (табл. 4.4). Утворення гормонорецепторно- го комплексу через G-білки (ГТФ-зв'язувальні білки) активує чи блокує аденілатциклазу, яка з АТФ утворює цАМФ. Цей внутрішньоклітинний месенджер викликає дисоціацію цАМФ-залежної протеїнкінази А (ПкА) на регуляторну й каталітичну субодиниці (цАМФ + ПкR → цАМФ-R + Пк). Остання активується і фосфорилює багато білків, переводячи їх таким чином в активний стан. Це збільшує, наприклад, розпад жирів і глікогенез, синтез катехоламінів, скорочення серця і інше, що пов'язано з підвищенням функціональної активності в цілому.

Рис. 4.17. Основні сигнал-трансдукторні системи клітини:
Ац - аденілатциклаза, Гц - гуанілатциклаза, КМ - кальмодулін, КМ-ПК - кальмодулінзалежна протеїнкіназа, ФлС - фосфоліпаза С, Фі - фосфоінозитиди, Фх - фосфатидилхолін, ІФз - інозитолтрифосфат, ДАГ - діацилгліцерол,
ІН - інсулін, ФРК - фактор росту клітин, ЦК - цитокіни, Тк - тирозинкіназа. Стрілками показано шляхи інтенсивного впливу
Інший вторинний месенджер - циклічний гуанозинмонофосфат (цГМФ) утворюється двома гуанілілциклазами: мембранною (активується натрійуретичними гормонами) і цитозольною (розчинною), яка активується монооксидами NO• CO i •OH. Останні є новим класом неорганічних регуляторів з міжклітинним і внутрішньоклітинним місцями регуляції. цГМФ активує Пк G теж шляхом її дисоціації (як і Пк А), а також змінює активності інших білків, активує іонні канали (цГМФ-чутливі канали), що важливо для сприйняття світла зоровими рецепторами.
Таблиця 4.3
Приклади вторинних месенджерів
Назва месенджерів |
Специфічні процеси, які ними регулюються |
Циклічний аденозинмонофосфат (цАМФ) |
Активація цАМФ-залежної протеїнкінази (ПкА) і цАМФ-залежних іонних каналів. Опосередковує ефекти адреналіну, глюкагону, лютеїнізуючого гормону. |
Циклічний гуанозинмонофосфат (цГМФ) |
Регуляція активності цГМФ-залежних протеїнкіназ (ПкG) і цГМФ-залежних каналів у сітківці, опосередкування ефектів NO. |
Оксид азоту (NО) |
Активує гуанілатциклазу (викликає зростання продукції цГМФ), розслаблює гладенькі м'язи. |
Діадилгліцерол (ДАГ) |
Активує ПкС; опосередковує ефекти гормонів вазопресину, ангіотензину, тиреотропіну. |
Інозитол-1,4,5-трифосфат (ІФ3) |
Спричиняє вихід Са із внутрішньоклітинних депо, зокрема ЕР; опосередковує ефекти гормонів вазопресину, ангіотензину, тіреотропіну. |
Фосфатидна кислота (1,2-діадил-гліцерофосфорна) та лізофосфатидна кислота (1 -адилгліцерофосфорна) |
Стимулює ріст фібробластів, гладеньких м'язів судин, ендотеліальних клітин, кератиноцитів, сприяє посиленню міжклітинних взаємодій і процесів репарації, активує фосфотидилінозитол-3-кіназу. |
Багато гормонів через G-білки активують фосфоліпазу С, яка з фосфатидилінозитидів мембран утворює два месенджери: іно- зитолтрифосфат (ІФ3) і діацилгліцерол (ДАГ), а з фосфатидилхоліну - лише ДАГ. ІФ3, зв'язуючись з рецепторами мембран ендоплазматичного ретикулума, викликає вихід іонів Ca2+ із нього в цитозоль. Іони Ca2+ як внутрішньоклітинний месенджер разом із білком кальмодуліном активують цитозольні ферменти безпосередньо або через Ca2+ -кальмодулінзалежну протеїнкіназу. Внутршньомемб- ранний месенджер ДАГ активує протеїнкіназу С і сам є попередником вторинного месенджера арахідонової кислоти (табл. 4.4).
Система мембранних рецепторів з тирозинкіназною активністю (фосфорилює білки за залишком тирозину, а не серину і треоніну, як цитозольні протеїнкінази). Утворення гормон(антиген)-рецепторного комплексу стимулює тирозинкіназну активність рецептора, результатом чого є фосфорилювання багатьох білків, у тому числі й фосфоліпази С (рис. 4.17).
Ядерні ефекти первинних сигнальних молекул найчастіше пов'язані з активацією тирозинкіназ і протеїнкіназ С і А. Установлено три основні механізми трансдукції цитозольних сигналів у внутрішньоядерні (рис. 4.18).

Рис. 4.18. Три шляхи трансдукції цитозольних сигналів у внутрішньоядерні сигнали:
ТК - тирозинкіназа, ТФ - транскрипційний фактор, ПК - протеїнкіназа, Р - залишок фосфату, І - інгібітор. → - транслокація сигнальної молекули в ядро. Пунктиром показано інші варіанти передачі сигналів. Ранні гени - відповідь у межах 15-20 хв, пізні гени - протягом години й діб
Усі три механізми пов'язані з протеїнкіназним фосфорилюванням регуляторних білків - транскрипційних факторів або їхніх попередників. При першому механізмі, характерному для дії сироватки крові або цАМФ-залежних гормонів, у ядро проникають активовані цитозольні Пк (МАР-кіназа: кіназа мітогенактивованого протеїну), або активна субодиниця ПК А. При другому механізмі (для факторів росту, цитокінів та інтерферонів - противірусних білків) сигнал у ядро передає не ПК, а фосфорильований нею білок. При третьому механізмі, який реалізує ефекти факторів росту клітин, активних форм кисню, ультрафіолету й регулює процеси запалення та імунітету, у білковому транскрипційному факторі відщеплюється фосфорильована інгібіторна одиниця. Кінцеві етапи в регуляції ядерних процесів різними гормонами (включаючи й жиророзчинні - рис. 4.16) близькі між собою: це взаємодія гормонорецепторного комплексу чи модифікованого транскрипційного фактору з регуляторними ділянками ДНК. мРНК, що синтезуються при транскрипції ранніх генів, синтезує білкові продукти, які стають новими транскрипційними факторами для пізніх генів. Ці три механізми не вичерпують усіх рівнів ядерної регуляції. Зростання концентрації Ca2+ та інші вторинні посередники можуть регулювати експресію генів як на посттранскрипційному, так і на трансляційному рівнях.
Зовнішні для клітини сигнальні молекули за рахунок "своїх" вторинних месенджерів регулюють і основні функції мітохондрій: ферментів циклу Кребса, дихального ланцюга окисного фосфорилювання. Схему передачі зовнішнього сигналу наведено на рис. 4.19, з якого видно, що первинний сигнал трансдукується в підвищення цитозольної концентрації вторинних месенджерів - Ca2+ і цАМФ. Для кальцію існує постійний обмін через внутрішню мітохондріальну мембрану (ВММ): вхід у матрикс за рахунок енергії мембранного потенціалу і вихід назад в обмін на Na2+ (або Н+) за рахунок енергії градієнта рН. Іони Ca2+ діють прямо на мітохондріальні ферменти як матриксу, так і ВММ. цАМФ взаємодіє з рецептором ВММ, а також проникає в усі компартменти мітохондрій, а в кожному з них є протеїнкінази А. Слід відмітити, що регуляція мітохондрій не обмежується чотирма гормонами і двома вторинними месенджерами (рис. 4.19). Нині встановлено, що функції мітохондрій стимулюються також цГМФ і протеїнкіназою С та іншими сигнальними молекулами.
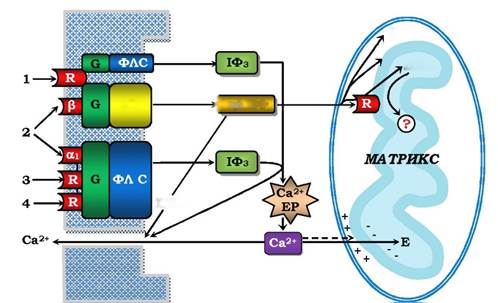
Рис. 4.19. Передача інформації сигнальних молекул до мітохондрій:
1 - глюкагон, 2 - катехоламіни, 3 - вазопресин, 4 - ангіотензин II, "+" і "-" - мембранний потенціал на внутрішній мембрані мітохондрій, Е - ферменти мітохондріального матриксу, інші позначення - як на рис. 4.16-4.18
Отже, у кожній клітині існує комплекс сигнал-трансдукторних систем, які трансформують усі зовнішні сигнали у внутрішньоклітинні месенджери, кінцевим результатом чого є активація ферментних і канальних систем. У ядро сигнали передаються шляхом транслокації до нього цитозольних протеїнкіназ або активованих транскрипційних факторів. У мітохондрії сигнал передається шляхом транслокації з цитозолю вторинних месенджерів (Ca2+ і цАМФ), які прямо діють на функціональні білки мітохондрій.
Використання вторинних месенджерів (посередників) (табл 4.4) і каскадів протеїнкіназ (у т. ч. мембранних тирозинкіназ) дозволяє різко підсилити різні реакції клітини на звичайний сигнал. Наприклад, одна молекула рецептора, активована лігандом, може активувати багато молекул Gs-білків. Кожна молекула активованих G-білків включає в роботу молекулу аденілатциклази. Кожна молекула аденілатциклази утворює багато молекул цАМФ. Аналогічні процеси відбуваються на інозитолфосфоліпідному шляху. У результаті наномолярні (10-9 моль/л) концентрації позаклітинного ліганду викликають утворення вторинних месендже- рів у мікромолярних (10-6 моль/л) концентраціях. Оскільки ці молекули є алостеричними ефекторами (активують білки, приєднуючись до них і змінюючи їхні конформації), то одна молекула ліганду активує тисячі молекул всередині клітини.