БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.1. Будова та властивості амінокислот, які входять до складу білків. Пептидні зв’язки
5.1.2. Класифікація амінокислот
Класифікація амінокислот за хімічною будовою радикалів. За хімічною будовою амінокислоти поділяють на аліфатичні, ароматичні та гетероциклічні (табл. 5.1).
Таблиця 5.1
Класифікація основних білкових амінокислот за хімічною будовою
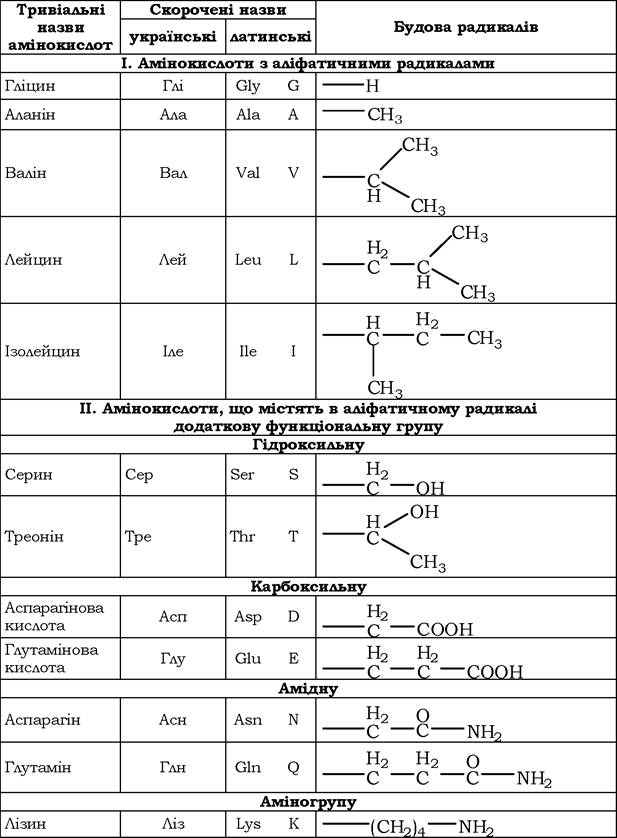
До складу аліфатичних радикалів можуть входити функціональні групи, котрі надають їм специфічних властивостей: карбоксильна, аміно, тіольна, амідна, гідроксильна та гуанідинова.
Назви амінокислот можна побудувати за замісною номенклатурою, але зазвичай використовують тривіальні назви (табл. 5.2).
Таблиця 5.2
Приклади назв амінокислот за замісною номенклатурою та відповідні тривіальні назви

Для запису амінокислотних залишків у молекулах пептидів і білків використовують трилітерні скорочення їхніх тривіальних назв, а в деяких випадках і однолітерні символи (табл. 5.1).
Тривіальні назви амінокислот часто походять від назви джерела, з якого вони вперше були виділені, або від властивостей даної амінокислоти. Наприклад, серин був уперше виділений із фіброїну шовку (від лат. serieum - шовковистий), а гліцин отримав свою назву через солодкий смак (від гр. glykos - солодкий).
Класифікація амінокислот за розчинністю їхніх радикалів у воді. Усі 20 амінокислот у білках організму людини можна згрупувати за здатністю їхніх радикалів розчинятися у воді. Радикали можна розмістити в неперервний ряд, який починається з повністю гідрофобних і закінчується повністю гідрофільними амінокислотами.
Розчинність радикалів амінокислот визначається полярністю функціональних груп, котрі входять до складу молекули (полярні групи притягують воду, неполярні її відштовхують).
Амінокислоти з неполярними радикалами. До неполярних (гідрофобних) належать радикали, що мають аліфатичні вуглеводневі ланцюги (радикали аланіну, валіну, лейцину, ізолейцину, проліну й метіоніну) і ароматичні кільця (радикали фенілаланіну та триптофану). Радикали таких амінокислот у воді прагнуть наблизитись один до одного або до інших гідрофобних молекул, унаслідок чого поверхня їхнього контакту з водою зменшується.
Амінокислоти з полярними незарядженими радикалами. Радикали цих амінокислот краще розчиняються у воді, ніж гідрофобні радикали, оскільки до їхнього складу входять полярні функціональні групи, які утворюють водневі зв'язки з водою. До них належать серин, треонін і тирозин, котрі мають гідроксильні групи, аспарагін і глутамін, що містять амідні групи, та цистеїн із його сульфгідрильною групою.
Цистеїн і тирозин містять відповідно сульфгідрильну й гідроксильну групи, здатні до дисоціації з утворенням Н+. При рН близько 7,0, що підтримується у клітинах, ці групи практично не дисоціюють.
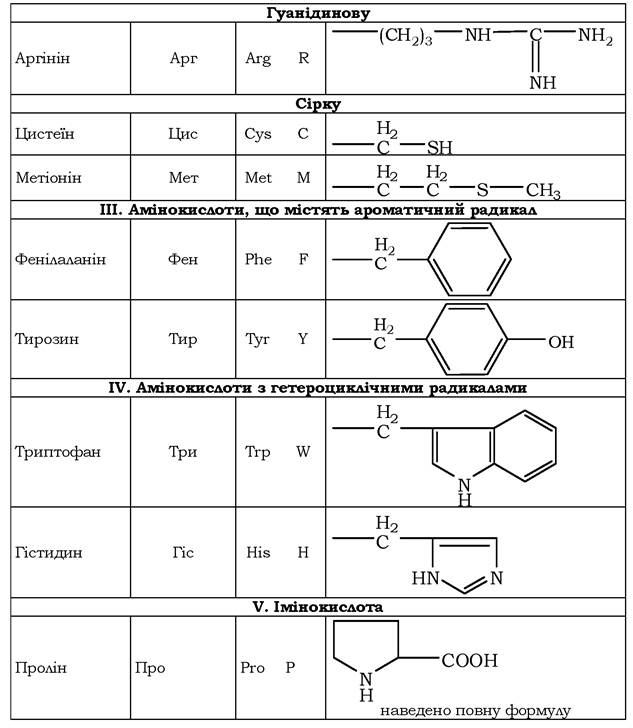
Амінокислоти з полярними негативно зарядженими радикалами. До цієї групи належать аспарагінова та глутамінова амінокислоти, що мають у радикалі додаткову карбоксильну групу. При рН близько 7,0 вони дисоціюють з утворенням СОО- та Н+. Отже, радикалами цих амінокислот є аніони. Іонізовані форми аспарагінової та глутамінової кислот називають відповідно аспартатом і глутаматом.
Амінокислоти з полярними позитивно зарядженими радикалами. Додаткову позитивно заряджену групу в радикалі мають лізин і аргінін. У лізині друга аміногрупа, яка здатна приєднувати Н+, розмішується в ε-положенні аліфатичного ланцюга. В аргініні позитивного заряду набуває гуанідинова група. Гістидин містить слабко іонізовану імідазольну групу, тому за фізіологічних коливань значень рН (від 6,9 до 7,4) він заряджений або нейтрально, або позитивно. При збільшенні кількості протонів у середовищі імідазольна група гістидину здатна приєднувати протон, набуваючи додатного заряду, а при збільшенні концентрації гідроксильних груп - віддавати протон, втрачаючи позитивний заряд радикала. Позитивно заряджені радикали - катіони (див. схему). Найбільш розчинні у воді полярні заряджені радикали амінокислот.
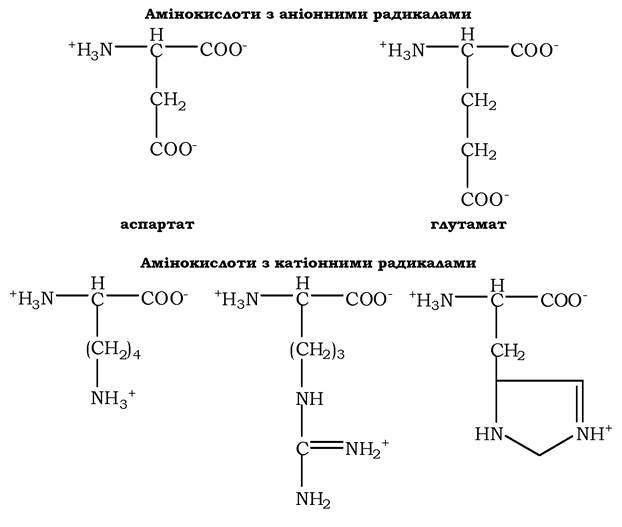
Зміна сумарного заряду амінокислот залежно від рН середовища. При нейтральних значеннях рН усі кислотні (здатні віддавати Н+) і всі основні (здатні приєднувати Н+) функціональні групи перебувають у дисоційованому стані.
Тому в нейтральному середовищі амінокислоти, які містять недисоціюючий радикал, мають сумарний нульовий заряд, ті, що мають кислотні функціональні групи - загальний від'ємний заряд, а амінокислоти, котрі містять основні функціональні групи, - позитивний (табл. 5.3).
Таблиця 5.3
Зміни сумарного заряду амінокислот залежно від рН середовища
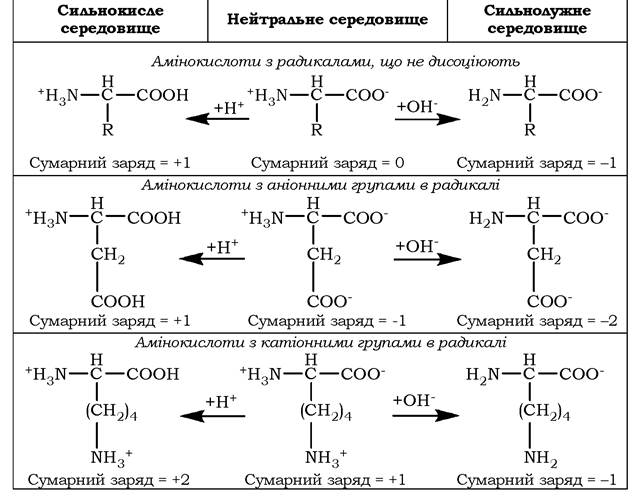
Зміна рН у кислий бік (тобто підвищення в середовищі іонів Н+) приводить до пригнічення дисоціації кислотних груп. У сильно кислому середовищі всі амінокислоти набувають додатного заряду. Збільшення концентрації ОН- груп, навпаки, викликає відщеплення Н+ від основних функціональних груп, що приводить до зменшення позитивного заряду.
Модифіковані амінокислоти, присутні в білках. Безпосередньо в синтезі білків організму людини беруть участь тільки 20 перерахованих амінокислот. Однак у деяких білках є нестандартні модифіковані амінокислоти - похідні однієї з 20 амінокислот. Наприклад, у молекулі колагену (фібрилярного білка міжклітинного матриксу) присутні гідроксипохідні лізину і проліну - 5-гідроксилізин і 4-гідроксипролін:
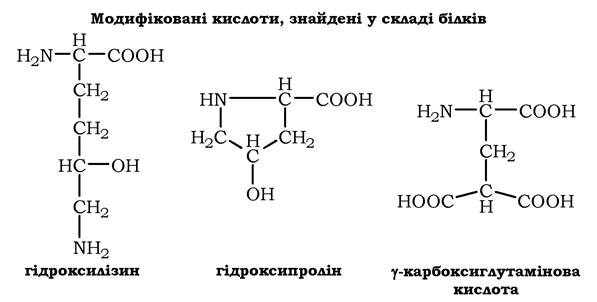
Модифікації амінокислотних залишків здійснюються вже у складі білків, тобто тільки після закінчення їхнього синтезу. Уведення додаткових функціональних груп у структуру амінокислот надає білкам властивостей, необхідних для виконання ними специфічних функцій. Так, γ-карбоксиглутамінова кислота входить до складу білків, що беруть участь у згортанні крові, і дві поряд розміщені карбоксильні групи в їхній структурі є необхідними для зв'язування білкових факторів з іонами Са2+. Порушення карбоксилювання глутамату приводить до зниження згортання крові.