БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.2. Структура білків
5.2.1. Первинна структура білка
Амінокислотні залишки в пептидному ланцюзі білків чергуються не випадковим чином, а розміщенні в певному порядку. Лінійну послідовність амінокислотних залишків у поліпептидно- му ланцюзі називають первинною структурою білка.
Первинна структура кожного індивідуального білка закодована в ділянці ДНК, яка називається геном. У процесі синтезу білка інформація, що знаходиться в гені, спочатку переписується на мРНК, а потім, використовуючи мРНК як матрицю, на рибосомі відбувається збирання первинної структури білка.

Рис. 5.3. Етапи формування конформації білків:
структури: 1- первинна, 2 - вторинна, 3 - третинна, 4 - четвертинна
Кожен із 50 000 індивідуальних білків організму людини має унікальну для даного білка первинну структуру. Усі молекули даного індивідуального білка мають однакове чергування амінокислотних залишків, що в першу чергу відрізняє даний індивідуальний білок від будь-якого іншого.
Методи вивчення первинної структури білка. Вивчення первинної структури білків має важливе загальнобіологічне й медичне значення. Вивчаючи порядок чергування амінокислотних залишків в індивідуальних білках і зіставляючи ці значення з особливостями просторового розміщення молекули, можна виявити загальні фундаментальні закономірності формування просторової структури білків.
Крім того, багато генетичних хвороб є результатом порушення амінокислотної послідовності білків. Інформація про первинну структуру нормального й мутантного білка може бути корисною для діагностики та прогнозування розвитку хвороби.
Установлення первинної структури білків складається з двох основних етапів:
✵ визначення амінокислотного складу білка, що вивчається;
✵ визначення амінокислотної послідовності білка.
Перший етап у визначенні первинної структури білків полягає в якісній і кількісній оцінці амінокислотного складу даного індивідуального білка. Необхідно пам'ятати, до для дослідження потрібно мати певну кількість чистого білка, без домішок інших білків чи пептидів.
Для визначення амінокислотного складу необхідно провести руйнування всіх пептидних зв'язків у білку. Білок, який аналізують, гідролізують у 6 моль/ л HCl при температурі 110 °С протягом 24 год. У результаті такої обробки руйнуються пептидні зв'язки в білку, а в гідролізаті присутні тільки вільні амінокислоти. Крім того, глутамін і аспарагін гідролізуються до глутамінової та аспарагінової кислот (тобто розривається амідний зв'язок у радикалі й від них відщеплюється аміногрупа).
Суміш амінокислот, отриманих кислотним гідролізом білків, розділяють у колонці з катіонообмінною смолою. Така синтетична смола містить міцно зв'язані з нею негативно заряджені групи (наприклад, залишки сульфанілової кислоти-SO3-), до яких приєднані іони Na+ (рис. 5.4).
У катіонообмінник вносять суміш амінокислот у кислому середовищі (рН 3,0), в якому амінокислоти в основному являють собою катіони, тобто несуть додатний заряд. Позитивно заряджені амінокислоти приєднуються до негативно заряджених частинок смоли. Чим більший загальний заряд амінокислоти, тим міцніші її зв'язки зі смолою. Так, амінокислоти лізин, аргінін і гістидин найміцніше зв'язуються з катіонообмінником, а аспарагінова й глутамінова кислота - найслабше.
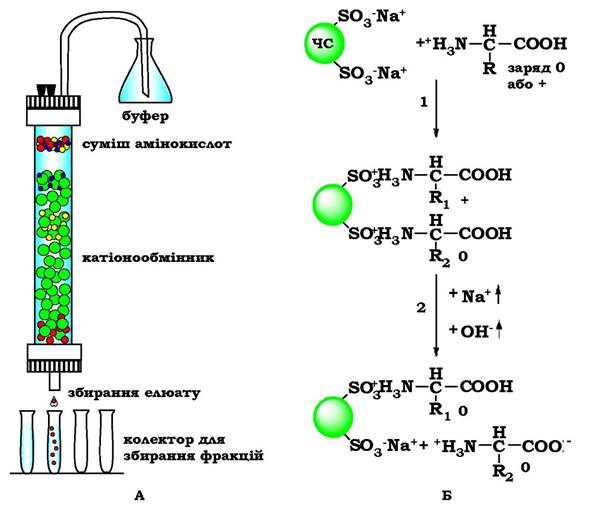
Рис. 5.4. Розділення амінокислот за допомогою іонообмінної хроматографії:
А - хроматографічна колонка, заповнена катіонообмінною смолою. Б - етапи розділення амінокислот: ЧС - частинки смоли;
1 - приєднання амінокислот до частинок смоли; 2 - вивільнення амінокислот при певному значенні рН і концентрації NaCl
Вивільнення амінокислот із колонки здійснюється вимиванням (елююванням) їх буферним розчином зі зростаючою іонною силою (тобто зі зростаючою концентрацією NaCl) і рН. При збільшенні рН амінокислоти втрачають протон, у результаті зменшується їхній позитивний заряд, а відповідно - і міцність зв'язку з негативно зарядженими частинками смоли.
Кожна амінокислота виходить із колонки при певному значенні рН та іонної сили. Збираючи з нижнього кінця колонки розчин (елюат) у вигляді невеликих порцій, можна отримати фракції, які містять окремі амінокислоти.
Кількість кожної з амінокислот у даному білку визначають, нагріваючи окремі фракції амінокислот з нінгідрином, що утворює сполуки червоно-фіолетового кольору. Інтенсивність забарвлення у пробі пропорційна кількості амінокислоти, що в ній міститься. За спектрофотометричним вимірюванням світла, поглинутого нінгідриновими похідними, можна визначити вміст кожної амінокислоти у гідролізаті даного білка.
Процес розділення і кількісного визначення амінокислот у гідролізаті білка є повністю автоматизованим і здійснюється у спеціальному приладі - амінокислотному аналізаторі.
Другий етап у визначенні первинної структури білків полягає у визначенні амінокислотної послідовності білка. Визначення N-кінцевої амінокислоти в білку та амінокислотної послідовності в олігопептидах здійснюється із застосуванням певних реагентів.
Фенілізотіоціонат (ФІТЦ) - реагент, який використовують для визначення N-кінцевої амінокислоти в пептиді. ФІТЦ реагує з α-аміно- та α-карбоксильною групами вільних амінокислот, а також із N-кінцевою амінокислотою в пептидах:
У результаті взаємодії з N-кінцевою амінокислотою поліпептиду утворюється фенілтіогідантіонова похідна, в якій дестабілізується пептидний зв'язок між α-карбоксильною групою N-кінцевої амінокислоти і α-аміногрупою другої кислоти в пептиді. Цей зв'язок вибірково гідролізується без пошкодження інших пептидних зв'язків:
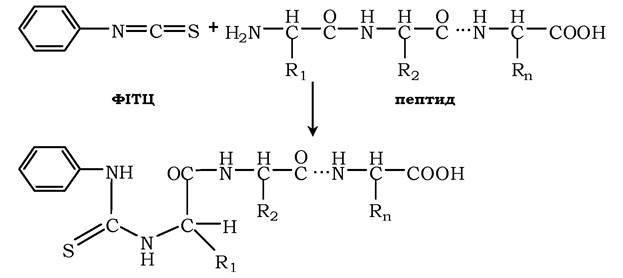
Після реакції виділяють комплекс ФІТЦ-АK1 та ідентифікують його хроматографічними методами. ФІТЦ можна використовувати знову для визначення наступної амінокислоти у вкороченого пептиду, що був отриманим у попередньому циклі. Цей процес послідовного ("крок за кроком») розщеплення пептиду з N-кінця був автоматизованим і реалізованим у приладі - секвенаторі, за допомогою якого можна визначати послідовність амінокислотних залишків в олігопептидах, котрі складаються з 10-20 амінокислот.
Багато пептидів мають первинну структуру, яка складається з більш ніж 100 амінокислот. Оскільки за допомогою секвенаторів найпродуктивніше визначають амінокислотну послідовність лише невеликих пептидів, великі молекули розщеплюють попередньо на фрагменти.
Використовуючи декілька різних розщеплювальних агентів (ними можуть бути ферменти або хімічні речовини) у різних пробах очищеного поліпептиду, можна отримати фрагменти з визначеною амінокислотною послідовністю, що частково перекривають один одного. За допомогою них можна відтворити правильний порядок фрагментів і отримати повну послідовність амінокислот у поліпептидному ланцюзі.
Для специфічного розщеплення пептидних зв'язків можна використовувати декілька різних ферментів. Найчастіше використовують ферментативний гідроліз поліпептиду протеолітичним ферментом - трипсином, який належить до групи травних ферментів (його виробляє підшлункова залоза). Фермент володіє високою специфічністю дії. Він розщеплює пептидні зв'язки, в утворенні яких беруть участь карбоксильна група залишків лізину або аргініну:

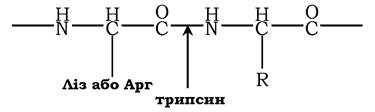
Виходячи з установленої кількості залишків лізину або аргініну, можна передбачити кількість отриманих під час гідролізу трипсином фрагментів. Так, у поліпептидному ланцюзі із шести залишків аргініну та лізину внаслідок розщеплення трипсином можна отримати сім фрагментів. Потім у кожному фрагменті встановлюють амінокислотну послідовність.
У деяких випадках віддають перевагу не ферментативному, а хімічному гідролізу. Так, реагент бромціан розщеплює тільки пептидні зв'язки, в яких карбоксильна група належить залишку метіоніну. Знаючи кількість залишків метіоніну в поліпептидному ланцюзі, легко встановити кількість майбутніх фрагментів. Далі для кожного фрагмента в секвенаторі також установлюють амінокислотну послідовність.
Для правильного встановлення послідовності отриманих фрагментів поліпептиду необхідно отримати пептиди з амінокислотними послідовностями, які перекриваються. Цього досягають обробкою окремих проб даного поліпептиду різними реагентами, що розщеплюють білок у різних місцях. Необхідно провести таку кількість розщеплень, щоб отримати набір пептидів, який забезпечує перекривання всіх ділянок, необхідних для визначення послідовності вихідного поліпептиду:

Лінійні поліпептидні ланцюги індивідуальних білків за рахунок взаємодії функціональних груп амінокислот набувають певної просторової тривимірної структури - конформації. Усі молекули індивідуальних білків (тобто тих, що мають однакову первинну структуру) утворюють у розчині однакову конформацію. Отже, уся інформація, необхідна для формування просторових структур, міститься у первинній структурі білків.
У білках розрізняють два основні типи конформації поліпептидних ланцюгів: вторинну та третинну структури.