БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.3. Формування тривимірної структури білка в клітині
5.3.1. Ренативація білків
Довгий час вважалося, що процес денатурації білків є необоротним. Проте виявилося, що деякі очищені й денатуровані білки здатні в дослідних умовах відновлювати конформацію при видаленні денатуруючих агентів.
На початку 60-х рр. ХХ ст. виявили, що процес денатурації білків може бути оборотним. Це відкриття було зроблено під час вивчення денатурації рибонуклеази - ферменту, що розщеплює
зв'язки між нуклеотидами в РНК. Рибонуклеаза - глобулярний білок з одним поліпептидним ланцюгом, який складається з 124 амінокислотних залишків. Його конформацію стабілізують 4 дисульфідні та багато слабких зв'язків.
Обробка рибонуклеази β-меркаптоетанолом (НО-СН2-СН2-SН) приводить до розриву дисульфідних зв'язків і відновленню SH-груп цистеїнових залишків, що порушує компактну структуру білка. Додавання 8 моль/л розчину сечовини або 6 моль/л розчину гуанідинхлориду, які викликають розрив слабких зв'язків у білку й утворення нових водневих зв'язків із денатуруючими агентами, приводить до утворення випадково згорнутих по- ліпептидних ланцюгів рибонуклеази, позбавлених ферментативної активності, тобто до денатурації ферменту. Денатуруючі агенти не руйнують первинну структуру білка.
Але якщо шляхом діалізу очистити рибонуклеазу від денатуруючих агентів і β-меркаптоетанолу, ферментативна активність білка поступово відновлюється. Цей процес називається ренату- рацією, або ренативацією білка. Сульфгідрильні групи денатурованого ферменту під дією кисню повітря окинюються, у результаті знову виникають 4 дисульфідні зв'язки, характерні для на- тивної структури білка. Зі 105 можливих способів зв'язування SH-груп залишків цистеїну реалізується тільки один варіант, характерний для нативної конформації білка (рис. 5.22).
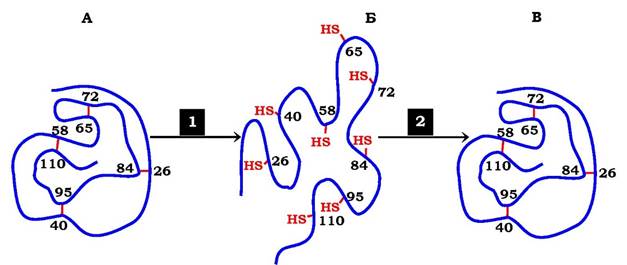
Рис. 5.22. Денатурація та ренативація рибонуклеази:
А - нативна молекула рибонуклеази, у третинній структурі якої є 4 дисульфідні зв'язки; Б - денатурована молекула рибонуклеази; В - нативна молекула рибонуклеази, у структурі якої знову утворені 4 дисульфідні зв'язки між тими самими залишками цистеїну; 1 - додавання сечовини і β-меркаптоетанолу; 2 - видалення сечовини й β-меркаптоетанолу
Можливість ренативації пізніше було доведено й для інших білків, зокрема міоглобіну. Збереження первинної структури білка - необхідна умова для відновлення її конформації. На основі цих дослідів був виведений фундаментальний принцип молекулярної біології: амінокислотна послідовність білків визначає їхню конформацію та специфічну функцію.
Формування просторової структури білка - самовільний процес, під час якого білок прагне прийняти конформацію з найменшою вільною енергією в даних умовах. Зміна умов оточуючого середовища або зміна первинної структури даного білка можуть призвести до зміни його конформації і функції.